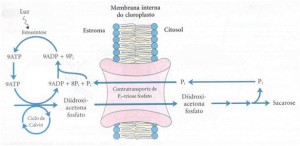
(1) SISTEMA DE TRANSPORTE: EXPORTAÇÃO DE TRIOSES FOSFATO E IMPORTAÇÃO DE FOSFATO
A membrana interna do cloroplasto é impermeável para a maioria dos compostos fosforilados, incluindo frutose-6-fosfato, glicose-6-fosfato e frutose-1,6-bifosfato. Entretanto, existe um transportador específico que catalisa a troca um por um de Pi por triose fosfato, que seja diidroxiacetona fosfato ou 3-fosfoglicerato. Esse transporte move simultaneamente a triose fosfato para fora do cloroplasto, ou seja, para o citosol, e o Pi para o interior dos cloroplastos, onde ele é empregado na fotofosforilação.
Sem esse sistema de transporte, a fixação de CO2 no cloroplasto rapidamente se tornaria impossível. Assim, o transporte efetivo das trioses fosfato para fora do cloroplasto faz a remoção das trioses fosfato oriundas da fixação do carbono. No citosol essas trioses fosfato são convertidas em sacaroses. A síntese da sacarose no citosol e a síntese do amido do cloroplasto são as duas grandes formas pelas quais o excesso de trioses fosfato são armazenadas. O último passo da síntese de sacarose libera uma molécula de Pi que, foi empregada para gerar uma triose fosfato. Para cada molécula de triose fosfato que sai do cloroplasto, um Pi é transportado para o interior do mesmo. Se esta troca for bloqueada a síntese de trioses fosfato rapidamente depletará o Pi disponível no cloroplasto e impedirá a continuação da fixação de CO2.
Este sistema de transporte Pi-triose fosfato tem uma outra função. No citosol existe uma grande variedade de rações sintéticas que consomem energia na forma de ATP e de força redutora química. Estas necessidades energéticas são supridas pelas mitocôndrias em um grau ainda indeterminado. Uma segunda fonte potencial desta energia são os ATP e NADPH gerados no estroma durante as reações luminosas da fotossíntese; entretanto, o ATP e o NADPH não cruzam a membrana do cloroplasto. O sistema de transporte tem o efeito indireto de mover o ATP e os equivalentes redutores através da membrana do cloroplasto. A diidroxiacetona fosfato formada no estroma pela fixação do CO2 é transportada para o citosol, onde ela é convertida pelas enzimas glicolíticas em 3-fosfoglicerato, gerando ATP e NADH. O 3-fosfoglicerato entra novamente no cloroplasto, completando o ciclo. O efeito final é o transporte de NADPH/NADH e ATP do cloroplasto para o citosol.
Figura 1. Sistema de transporte de triose fosfato na membrana interna do cloroplasto (LEHNINGER, 1995)
O sistema de transporte triose fosfato na membrana interna do cloroplasto facilita a transferência do Pi citossólico por diidroxiacetona fosfato estromal. Os produtos da fixação fotossintética do carbono são movidos para o citossol, onde funcionam como ponto de partida para a biossíntese da sacarose e o fosfato necessário para a fotofosforilação é transferido para o estroma (LEHNINGER, 1995).
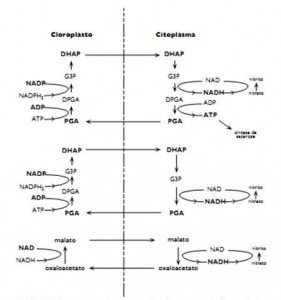 Figura 2. Transporte e interconversão de trioses e ácidos orgânicos entre cloroplasto e citoplasma. Fonte: Pimentel (1998).
Figura 2. Transporte e interconversão de trioses e ácidos orgânicos entre cloroplasto e citoplasma. Fonte: Pimentel (1998).
(2) REGULAÇÃO DA SÍNTESE DE AMIDO E SACAROSE
Estudos que utilizam micrografia eletrônica, mostrando grandes depósitos de amido nos cloroplastos, não deixam dúvidas de que este é o sítio de síntese de amido. As evidências de que o citossol é o sítio de síntese de sacarose são baseadas em estudos de fracionamento de células, nos quais as organelas são separadas a partir de conteúdos do citossol. As enzimas sacarose-fosfato sintase e sacarose-fosfato fosfatase são encontradas apenas em frações do citossol.
As rotas de síntese de amido e sacarose têm algumas etapas em comum, a exemplo daquelas que envolvem as enzimas frutose-1,6-bifosfato fosfatase e hexose-fosfato isomerase. No entanto, essas enzimas têm isoenzimas que possuem diferentes propriedades e são únicas em compartimentos celulares específicos. Por exemplo, a frutose-1,6-bifosfato fosfatase, presente no cloroplasto, é regulada pelo sistema tiorredoxina e é insensível à frutose-2,6-bifosfato e ao AMP. Entretanto, a sua isoenzima, encontrada no citossol, sofre regulação pela frutose-2,6-bifosfato.
O amido é sintetizado a partir da triose fosfato via frutose-1,6-bifosfato. A glicose-1-fosfato intermediária é convertida a ADP-glicose, via uma ADP-glicose pirofosforilase em uma reação que requer ATP e produz pirofosfato (PPi).
Assim como em muitas reações biossintéticas, o pirofosfato é hidrolisado a duas moléculas de ortofosfato (Pi) por meio de uma pirofosfatase inorgãnica específica acionando, deste modo, a reação 5 na direção da síntese de ADP-glicose. Por fim, a porção glicose da ADP-glicose é transferida para a extremidade não-redutora da glicose terminal de uma cadeia de amido em crescimento, completando, assim, a seqüência de reações.
O sítio de síntese da sacarose foi estudado por fracionamento celular, onde as organelas são isoladas e separadas umas das outras. Análises enzimáticas mostram que a síntese de sacarose ocorre no citosol a partir de trioses fosfato, por uma rota similar à rota de síntese do amido – ou seja, via frutose-1,6-bifosfato e glicose-1-fosfato.
Na síntese de sacarose, a glicose-1-fosfato é convertida a UDP-glicose por intermédio de uma UDP-glicose fosforilase específica, análoga ´ADP-glicose pirofosforilase dos cloroplastos. Nesse estágio, duas reações consecutivas completam a síntese de sacarose. Primeiro, a sacarose-6-fosfato sintase catalisa a reação da UDP-glicose com a frutose-6-fosfato, produzindo sacarose-6-fosfato e UDP. Segundo, a sacarose-6-fosfato fosfatase remove o fosfato da sacarose-6-fosfato, produzindo sacarose. Esta última reação, que é essencialmente irreversível, move a primeira reação na direção da síntese da sacarose.
Assim como na síntese do amido, o pirofosfato formado na reação catalisada pela UDP-glicose pirofosforilase é hidrolisado, porém não imediatamente como nos cloroplastos. Em decorrência da ausência de uma pirofosfatase inorgânica, o pirofosfato pode ser utilizado por outras enzimas em reações de transfosforilação.
A conversão das trioses fosfato a glicose-1-fosfato nas rotas que levam á síntese do amido e da sacarose possuem várias etapas em comum. Entretanto, tais rota utilizam isoenzimas que são específicas ao cloroplasto ou citosol.
As isoenzimas apresentam propriedades marcadamente diferentes. A frutose-1,6-bifosfatase do cloroplasto é regulada pelo sistema da tiorredoxina, mas não pela frutose-1,6-bifosfato e AMP. por outro lado, a forma citosólica da enzima é regulada pela frutose-1,6-bifosfato na presença de frutose-1,6-bifosfato, e não é afetada pela tiorredoxina.
Com exceção da frutose-1,6-bifosfatase do citosol, a síntese de sacarose é regulada em nível de sacarose fosfato sintse, uma enzima alostérica ativada pela glicose-6-fosfato e inibida pelo ortofosfato. A enzima é inativada no escuro pela fosforilação de um resíduo específico de serina via uma proteína quinase e ativada na luz pela desfosforilação via uma proteína fosfatase. A glicose-6-fosfato inibe a quinase, enquanto o Pi inibe a fosfatase (Figura 3).
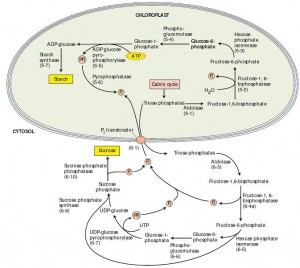 Figura 3. Síntese de amido e sacarose: processos competidores que ocorrem no cloroplasto e no citosol, respectivamente. Quando a concentração de Pi citosólico é alta, a triose fosfato do cloroplasto é exportada para o citosol através de um transportador de Pi, em troca de Pi e a sacarose é sintetizada. Quando a concentração citosólica de Pi é baixa, a triose fosfato é retida dentro do cloroplasto e o amido é sintetizado (Taiz & Zeiger, 2004).
Figura 3. Síntese de amido e sacarose: processos competidores que ocorrem no cloroplasto e no citosol, respectivamente. Quando a concentração de Pi citosólico é alta, a triose fosfato do cloroplasto é exportada para o citosol através de um transportador de Pi, em troca de Pi e a sacarose é sintetizada. Quando a concentração citosólica de Pi é baixa, a triose fosfato é retida dentro do cloroplasto e o amido é sintetizado (Taiz & Zeiger, 2004).
(3) AS SÍNTESES DE AMIDO E SACAROSE SÃO REAÇÕES COMPETITIVAS, REGULADAS POR METABÓLITOS-CHAVES
Excessos de trioses-fosfato podem ser usados tanto para a síntese de amido nos cloroplastos quanto para a síntese de sacarose no citossol. Assim, as sínteses de amido e sacarose são processos competitivos, e algumas condições que promovem um processo inibem o outro. Os componentes-chaves que regulam o seu particionamento são: as relativas concentrações de ortofosfato (Pi) e triose-fosfato no citossol e no cloroplasto; e a concentração de frutose-2,6-bifosfato no citossol. Os dois compartimentos se comunicam com uma outra via, a do translocador fosfato / triose-fosfato, por meio de uma proteína de transporte, localizada na membrana do cloroplasto, que catalisa o movimento de ortofosfato e triose-fosfato em sentidos opostos entre os dois compartimentos.
Baixas concentrações de ortofosfato no citossol limitam a exportação de trioses-fosfato através do translocador. Assim, a triose-fosfato é usada para a síntese de amido. No cloroplasto, a enzima ADP-glicose pirofosforilase, uma componente da rota de síntese do amido, é estimulada pelo 3-fosfoglicerato e inibida pelo ortofosfato. Uma alta relação 3-fosfoglicerato/ortofosfato é tipicamente encontrada em cloroplastos armazenadores de amido. Por outro lado, uma abundância de ortofosfato no citossol inibe a síntese de amido no cloroplasto e promove a exportação de triose-fosfato para o citossol, enquanto ele é convertido em sacarose.
A síntese de sacarose no citossol é fortemente regulada pela frutose-2,6-bifosfato. Este composto é encontrado no citossol em concentrações minúsculas e exerce um efeito regulador na interconversão de frutose-1,6-bifosfato e frutose-6-fosfato, que ocorre no citossol. A produção citossólica de frutose-2,6-bifosfato é associada ao decréscimo da síntese de sacarose, porque frutose-2,6-bifosfato é um forte inibidor da enzima citossólica frutose-1,6-bifosfato fosfatase é um ativador da fosfofrutoquinase pirofosfato-dependente.
A frutose-2,6-bifosfato é sintetizada a partir da frutose-6-fosfato, sob ação da enzima frutose-6-fosfato 2-quinase, e é degradada pela frutose-2,6-bifosfato fosfatase (não confundir com a frutose-1,6-bifofato fosfatase). O ortofosfato estimula a frutose-6-fosfato 2-quinase e inibe a frutose-2,6-bifosfato fosfatase, enquanto a triose-fosfato inibe a frutose-6-fosfato 2-quinase. Conseqüentemente, uma baixa relação triose-fosfato / ortofosfato, no citossol, promove a formação de frutose-2,6-bifosfato, que, na verdade, inibe a hidrólise de frutose-1,6-bifosfato citossólica e promove lentamente o aumento da síntese de sacarose. Uma alta relação triose-fosfato/ortofosfato tem o efeito inverso.
(4) A TREALOSE-6-FOSFATO PODE REGULAR A FOTOSSÍNTESE
Os genes da trealose 6 fosfato têm uma função perceptiva no status de carbono talvez pela sua interação com a hexoquinase (Goddijn e Smeekens, 1998). Significativamente, a capacidade fotossintética por unidade de área foliar em transgênicos de tabaco expressando o transgene trealose fosfato fosfatase (TPS) é alta. Plantas que expressam o transgene TPS e apresentam elevadas taxas de trealose 6 fosfato percebem um déficit de carbono e regulam a fotossíntese.
(5) MECANISMOS PELO QUAL O BALANÇO C/N REGULA A FOTOSSÍNTESE
O metabolismo do carbono está intrinsecamente ligado ao metabolismo do nitrogênio e qualquer efeito nas alterações na abundância do carbono afeta o metabolismo do nitrogênio e vice-versa (Noctor e Foyer, 2000). A utilização da sacarose no crescimento dos órgãos dreno depende simultaneamente do suprimento de aminoácidos. A assimilação do nitrato e amônio na parte aérea e raiz, para produzir aminoácidos requer ATP, poder redutor e esqueletos de carbono. Estes são providos pela fotossíntese, glicólise e respiração. A integração dessas rotas requer um repertório de sinais que permite a mudança gradativa da regulação molecular na expressão de genes para o metabolismo do carbono e nitrogênio. Alterações no fluxo de carbono através da hexoquinase em combinação com o prevalecimento da razão de assimilação de N pode modificar o tamanho do pool de 2 –oxoglutarato, acetil Co-A e possivelmente a razão AMP/ATP os quais poderiam modificar a expressão da Rubisco e dos genes envolvidos na fotossíntese (PAUL & FOYER, 2001).
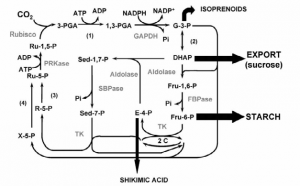 Figura 4. Modelo simplificado de como o controle fonte-dreno regulam a capacidade fotossintética e o desenvolvimento foliar. Fonte: Paul e Foyer, 2001.
Figura 4. Modelo simplificado de como o controle fonte-dreno regulam a capacidade fotossintética e o desenvolvimento foliar. Fonte: Paul e Foyer, 2001.
A glutamina e o 2-oxoglutarato são também metabólitos chave na interação C/N. A glutamina atua antagonisticamente ao 2-oxoglutarato e sacarose na regulação da transcrição da redutase do nitrato (NR) (FERRARIO-MERRY et al., 2000). Embora a glutamina não tenha um efeito direto na transcrição da Rubisco, a glutamina responde sensivelmente ao suprimento de nitrato e sacarose (SCHEIBLE et al., 1997). A expressão do gene do fosfoenolpiruvato carboxilase é controlada pelo suprimento de nitrogênio particularmente na presença de citocinina. A PEP carboxilase é ativada pelo aumento do pool de glutamina foliar favorecendo o fluxo de carbono através da rota anaplerótica (MURCHIE et al., 2000).
Assim como 2-oxoglutarato, o acetil Co-A tem uma função no metabolismo do carbono no cloroplasto sendo envolvido na rota dos aminoácidos, ácidos graxos e metabolismo dos nucleotídeos (SHEEN, 1990).
(6) O ACÚMULO DE ASSIMILADOS NA FOLHA REGULA A FOTOSSÍNTESE
A fotossíntese é regulada por processos metabólicos que maximizam o uso da disponibilidade de luz para minimizar os efeitos prejudiciais do excesso de luz e otimizar o uso das fontes de carbono e nitrogênio. Um desses processos regulatórios ocorre quando há excesso de carboidratos em folhas, promovido pelo desbalanço entre fonte e dreno o que resulta a um decréscimo da expressão dos genes ligados a fotossíntese, resultando em uma senescência foliar acelerada. Entretanto, a regulação dos órgãos fonte da fotossíntese é altamente dependente da fisiologia do resto da planta. Suprimentos de fotoassimilados e fitohormônios, particularmente citocininas, interagem com o suprimento de nitrogênio para controlar a expressão dos genes da fotossíntese, o desenvolvimento de folhas e a distribuição de nitrogênio na planta (PAUL & FOYER, 2001).
As folhas fonte sustentam altas razões de fotossíntese.e depende não só das reações entre as membranas dos tilacóides e estroma, mas também das trocas de metabólitos com o citosol e com outras organelas como a mitocôndria.
O ATP e poder redutor (NADPH, NADH e Fd) são gerados simultaneamente no cloroplasto durante o transporte de elétrons e fotofosforilação. Eles são consumidos na assimilação de elementos inorgânicos (C, N, S) pelos quais ATP e potencial redutor podem ser regenerados pelo processo oxidativo como a respiração. A respiração inclui fosforilação oxidativa na mitocôndria que possibilita a redução do poder redutor (NADPH) (NOCTOR & FOYER, 1998)(Figura 1). O fluxo respiratório, por exemplo, é necessário na luz para produzir oxiácidos como o 2 – oxoglutarato (KROMER, 1995). Isso é essencial para a incorporação do NH4+ dentro dos aminoácidos no cloroplasto. O NAD(P)H produzido como resultado deste fluxo de carbono oxidativo pode ser re-oxidado pelo sistema de transporte de elétrons na mitocôndria, gerando ATP. Este ATP é então transportado de dentro do cloroplasto para um transportador de adenilato no envelope do cloroplasto, juntando-se ao ATP produzido pela fotofosforilação (NOCTOR & FOYER, 2000).
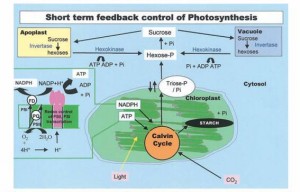 Figura 5. Controle redox dos cloroplastos para a expressão de genes que permitem respostas transcricionais com minutos de perturbação no estado redox. Fonte: Paul e Foyer (2001).
Figura 5. Controle redox dos cloroplastos para a expressão de genes que permitem respostas transcricionais com minutos de perturbação no estado redox. Fonte: Paul e Foyer (2001).
(7) CERTAS ENZIMAS DO CICLO DE CALVIN SÃO ATIVADAS DIRETAMENTE PELA LUZ
São cinco as enzimas reguladas pela luz que operam no ciclo de Calvin: 1) rubisco (regulação); 2) NADP gliceraldeído-3-fosfato desidrogenase; 3) frutose-1,6-bifosfatase; 4) sedoheptulose-1,7-bifosfatase; 5)ribulose-5-fosfato quinase.
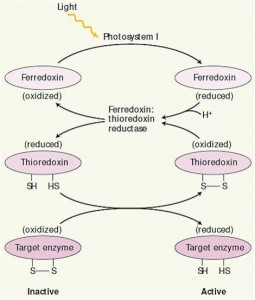
A enzima da fase de redução (desidrogenase do gliceraldeído-3-fosfato) e as três enzimas da fase de regeneração são controladas pelo sistema ferredoxina-tiorredoxina. Estas quatro enzimas possuem um ou mais grupos dissulfeto (S-S). No escuro estes resíduos estão na forma oxidada, deixando a enzima inativa ou subativa. Na luz, os elétrons da ferredoxina, via tiorredoxina, são utilizados para reduzir o grupo S-S para o estado sulfidrila (SH). A mudança promove a ativação da enzima.
Tradicionalmente, a análise das vias metabólicas foca sobre o estudo das propriedades cinéticas de enzimas individuais. Esta abordagem leva à identificação de uma série de “enzimas chave” do ciclo de Calvin, tais como Rubisco, SBPase, FBPase e PRKase. Esta classificação foi baseada no fato de que a atividade destas enzimas foi regulamentada por uma série de fatores,incluindo a luz, pH estroma [Mg2], e que catalisam reações que eram mais ou menos irreversíveis (PORTIS et al 1977;. WOODROW & BERRY, 1988).
As enzimas como a Rubisco, sedoheptulose-1,7- bisfosfatase, aldolase e transcetolase dominam o controle da fotossíntese.
A fixação redutiva do CO2 requer ATP e NADPH e suas concentrações no estroma aumentam quando os cloroplastos são iluminados. O transporte de prótons induzidos pela luz através da membrana tilacóide também transforma o compartimento estromal em alcalino e é acompanhado pelo fluxo de Mg2+ para fora do compartimento tilacóide em direção ao estroma. Várias enzimas do estroma evoluíram para tomar vantagem dessas condições dependentes de luz que sinalizam a disponibilidade de ATP e NADPH; eles têm o pH ou Mg2+ ótimos que são melhora adaptados para condições alcalinas e alta concentração de Mg2+. A ativação de rubisco pela formação de carbamato de lisina é mais rápida em pH alcalino, e altas concentrações no estroma de Mg2+ favorecem a formação de complexo ativo com o Mg2+. A frutose-1,6-bifosfatase requer Mg2+ e é muito dependente do pH. A sua atividade aumenta por um fator maior que 100 quando o pH e a concentração de Mg2+ aumentam durante a iluminação do cloroplasto.
As três outras enzimas essenciais para a operação do ciclo de Calvin submetidas a outro tipo de regulação pela luz, a ribulose-5-fosfato quinase, frutose-1,6-bifosfatase e sedoeptulose-1,7-bifosfatase, podem existir em duas formas alternativas que diferem entre si apenas no estado de oxidação de um resíduo de cisteína essencial para sua atividade catalítica. Quando esses resíduos de cisteína são oxidados como pontes dissulfetos, as enzimas tornam-se inativas; esta é a situação normal no escuro. Com a iluminação os elétrons fluem do fotossistema I para a ferredoxina, a qual passa os elétrons para uma proteína pequena e solúvel que contém grupo dissulfeto chamada tiorredoxina. A tiorredoxina fornece os seus elétrons para a redução das pontes dissulfeto destas enzimas ativadas pela luz e, a seguir, é reativada em uma reação de troca de dissulfetos catalisada pela tiorredoxina redutase (Figura 6).
Figura 6- O sistema ferredoxina-tiorredoxina reduz enzimas específicas na luz. A partir da redução, as enzimas biossintéticas são convertidas do estado inativo para um estado ativo. O processo de ativação inicia na luz pela redução da ferredoxina pelo fotossistema I. A ferredoxina reduzaida mais dois prótons são utilizados para reduzir o grupo catalítico ativa o dissulfito da enzima ferro-sulfurosa ferredoxina;tiorredoxina redutase, o que , por sua vez, reduz a ligação dissulfito altamente específica da pequena proteína regulatória tiorredoxina. A forma reduzida da tiorredoxina reduz então a ligação dissulfito crítica de uma enzima alvo, levando á ativação daquela enzima. O sinal de luz é assim convertido a um sinal sulfidril, ou via ferredoxina e a enzima ferredoxina:tiorredoxina redutase.
A inativação das enzimas alvo, observada durante o escurecimento, parece ocorrer por uma reversão da rota de redução (ativação). Isto é, o oxigênio converte a tiorredoxina e as enzimas alvo do estado reduzido para o estado oxidado, levando assim, à inativação da enzima.
(8) TRANSCETOLASES
Reduções na atividade das transcetolases têm efeitos sobre a partição de carbono entre a sacarose e vias biossintéticas de amido. Níveis de sacarose diminuem linearmente com a redução na atividade da transcetolase . Outra conseqüência interessante na redução na atividade das transcetolases é a diminuição na biossíntese de aminoácidos aromáticos e intermediários da via do ácido chiquímico, indicando que a disponibilidade de esqueletos de carbono do ciclo de Calvin poderá controlar o fluxo de carbono no metabolismo de fenilpropanóides. O gliceraldeído 3 fosfato desidrogenase, frutose-1,6-bisfosfatase ou fosforibuloquinase têm pouco controle sobre a fixação de carbono pela fotossíntese (ver figura 4).
Um modelo de captação de CO2 foi desenvolvido por Farquar e colegas particionando a limitação da fotossíntese entre a atividade da Rubisco e da capacidade da RuBP para regeneração (von Caemmerer et al. 2000). Este modelo prevê que, sob saturação de luz, condições de CO2 limitantes, a atividade Rubisco é o determinante para a fixação de carbono. Aplicação deste modelo demonstrou que o equilíbrio de co-limitação de fixação de carbono pela fotossíntese é dividida entre carboxilação e regeneração, sob uma ampla gama de condições em um grande número de espécies de plantas (Evans 1983). O modelo de cinética do ciclo de Calvin, desenvolvido pela Fell e Poolman, também previu que o controle do fluxo de carbono pela fotossíntese é susceptível de ser limitada pela regeneração da Rubisco e com a enzima SB-Pase sendo a principal enzima controladora nesta fase do ciclo.
As informações obtidas a partir das análises centrais de ciclo antisense de Calvin sugeriu que o aumento nos níveis de SBPase e, em menor grau, transcetolase ou aldolase, pode levar a um aumento na fixação de carbono.