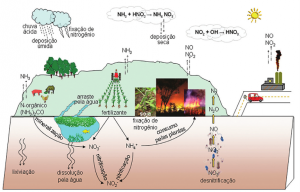
A atmosfera contribui com o fornecimento do nitrogênio gasoso e com pequena parcela de nitrogênio combinado nas formas de amônio (NH4+) e de nitrato (NO3–), originados da queimas industriais, de atividades vulcânicas e de incêndios florestais e pela oxidação do N2 na presença de descargas elétricas ou de radiação ultravioleta. O amônio e o nitrato produzidos na atmosfera são transportados para o solo pela chuva, podendo ser prontamente absorvidos pelas raízes.
Geralmente as formas disponíveis ou combinadas de nitrogênio para a nutrição dos seres vivos incluem as combinações amoniacais (NH4+), nítricas (NO3–) ou orgânicas (R-NH2) que são metabolizadas visando a construção de biomassa. Salienta-se que a disponibilidade biológica do nitrogênio (N) no solo, juntamente com o fósforo (P), enxofre (S) e potássio (K) tem relação direta com a produtividade agrícola. Certas bactérias do solo e as algas azuis dos oceanos convertem o nitrogênio do ar em amônia, que pode ser diretamente absorvida por alguns vegetais.
O nitrogênio combinado no solo é o mais susceptível dos compostos às transformações biológicas. As plantas geralmente o absorvem na forma de compostos altamente oxidados, dos quais o nitrato é o principal deles. Após absorção, esses compostos devem ser reduzidos para que sejam incorporados nos diversos constituintes celulares. Portanto, nos animais e nas plantas, o nitrogênio encontra-se, na sua maioria, na forma reduzida como íon amônio (NH4+) ou amina (NH2–). No outro extremo, o nitrato, principal forma em que o nitrogênio é encontrado no solo, é altamente oxidado, sendo necessária a adição de 8 elétrons para que se converta em amina, o que demanda um grande gasto de energia. O nitrogênio disponível para as plantas pode ser também oriundo diretamente de fertilizantes industriais, representando uma parcela muito pequena em relação ao total do nitrogênio fixado biologicamente.
Apesar de abundante na atmosfera, o nitrogênio molecular não pode ser absorvido pelas plantas. Exceto pelos microrganismos fixadores ou via adubação nitrogenada, a principal forma de obtenção desse elemento pelas plantas é o aproveitamento do nitrogênio combinado na matéria orgânica. Com o uso das plantas na alimentação dos animais, os compostos nitrogenados são utilizados para produção de novas proteínas. Com a morte dos organismos, bactérias presentes no solo decompõem os compostos orgânicos nitrogenados em aminoácidos, que, por sua vez, são oxidados pelos microrganismos do solo como bactérias e fungos com produção de gás carbônico, água e amônia (amonificação). Em determinadas situações, como os solos frios, ácidos e deficientes em oxigênio, o amônio é a principal fonte de nitrogênio, sendo utilizado na constituição de aminoácidos, uma vez que as bactérias nitrificantes não são abundantes e, quando presentes, são menos eficientes.
Em solos úmidos e quentes, o amônio oxidado a nitrito (NO2–) por bactérias nitrificadoras, como as Nitrosomonas, e este a nitrato (NO3–), por bactérias como as Nitrobacter. No solo, o íon amônio encontra-se adsorvido nas partículas coloidais, enquanto o nitrato, por ter carga negativa, torna-se componente da solução sendo facilmente lixiviado nessa condição. A perda de compostos nitrogenados do solo para a atmosfera, ou mesmo para rios, lagos ou mares, pode ocorrer de várias formas, principalmente por volatilização da amônia, por desnitrificação ou por lixiviação. A adubação excessiva com sais de nitrato, seguida de chuva abundante, faz com que esses sais sejam carreados para lençóis freáticos, lagos ou rios, constituindo fortes agentes poluidores. Além disso, os vegetais perdem, por lixiviação, pequenas quantidades de NH3+, N2O, NO2 e NO.
Esse tipo de processo ocorre em camadas relativamente profundas do solo, em solos compactados, em áreas alagadas, situações típicas de anoxia, ou mesmo em regiões próximas da superfície, com baixa concentração de oxigênio, em função de sua rápida utilização na oxidação da matéria orgânica. As formas oxidadas de nitrogênio na atmosfera têm importante papel ecológico porque, quando convertidas para NO, contribuem para formação do ácido. Com isso podemos resumir todas essas reações no ciclo do nitrogênio (Figura 1).
Figura 1. Ciclo do Nitrogênio (Fonte: Google Imagens)