Enquanto os animais utilizam as gorduras para o armazenamento de energia, as plantas as utilizam principalmente para armazenar carbono. Gorduras e óleos são formas importantes de armazenagem de carbono reduzido em muitas sementes, incluindo aquelas de espécies agronomicamente importantes, como soja, girassol, amendoim e algodão. Os óleos têm uma grande função de armazenagem em plantas não-domesticadas que produzem sementes pequenas. Alguns frutos, como abacates e azeitonas, também armazenam gorduras e óleos.
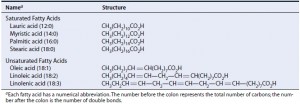
As gorduras e os óleos existem principalmente na forma de triacilgliceróis (acil refere-se à porção de ácido graxo) ou triglicerídeos , nos quais as moléculas de ácidos graxos são unidas por ligações ésteres aos três grupos hidroxilas do glicerol. Os ácidos graxos em plantas são normalmente ácidos carboxílicos de cadeia reta com um número par de átomos de carbono. As cadeias de carbono podem ser tão curtas quanto de 12 unidades ou tão longas quanto de 20, mas mais comumente elas têm 16 ou 18 átomos de carbono de extensão. Os principais ácidos graxos nos lipídeos vegetais são mostrados na Tabela 1.
Tabela 1. Ácidos graxos comuns em tecidos de vegetais superiores. Fonte: Taiz e Zeiger, 2004.
Na maioria das sementes, os triacilgliceróis são armazenados no citoplasma das células do cotilédone ou endosperma, em organelas conhecidas como olessomos (também chamadas de esferossomos ou corpos lipídicos). Os oleossomos tem uma barreira de membrana pouco usual, que separa os triglicerídeos do citoplasma aquoso. Uma camada única de fosfolipídeos circunda o corpo lipídico, com as extremidades hidrofílicas dos fosfolipídeos expostas ao citosol e as cadeias hidrofóbicas de hidrocarbonetos acil para o interior de triacilgliceróis. O oleossomo é estabilizado pela presença de proteínas específicas, denominadas olesinas, que cobrem a superfície e impedem que os fosfolipídeos de corpos lipídicos adjacentes entrem em contato e se fusionarem.
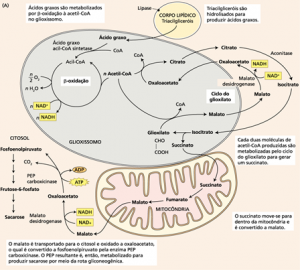
Depois de germinarem, as sementes oleaginosas metabolizam os triacilgliceróis armazenados, convertendo os lipídeos em sacarose. As plantas não são capazes de transportar gorduras de endosperma para os tecidos radiculares e de órgãos aéreos da plântula em germinação, de modo que elas precisam converter os lipídeos armazenados em uma forma mais móvel de carbono, geralmente sacarose, processo que envolve diversas etapas, as quais estão localizadas em diferentes compartimentos celulares: oleossomos, glioxissomos, mitocôndrias e citosol.
A conversão de lipídeos em sacarose em sementes oleaginosas é desencadeada pela germinação começando com a hidrólise dos triacilgliceróis armazenados nos corpos lipídicos para liberar os ácidos graxos, seguida da oxidação dos ácidos graxos para produzir acetil-CoA. Os ácidos graxos são oxidados no peroxissomo denominado glioxissomo, uma organela delimitada por uma única camada de membrana, que é encontrada nos tecidos de armazenagem da semente rica em óleos. A acetil-CoA é metabolizada no glioxissomo para produzir succinato, o qual é transportado do glioxissomo para a mitocôndria, onde é convertido primeiro a oxaloacetato e então a malato. O processo termina no citosol, com a conversão do malato a glicose via glicogênese e, então, a sacarose (Figura 1).
Figura 1. Conversão de gorduras em açúcares durante a germinação de sementes oleaginosas. Fonte: Taiz e Zeiger, 2013.
Embora alguns desses carbonos derivados dos ácidos graxos sejam desviados para outras reações metabólicas em algumas sementes oleaginosas, na mamona (Ricinus communis) o processo é tão eficiente que cada grama de lipídeo metabolizado resulta na formação de 1g de carboidrato, o que é equivalente a 40% de recuperação da energia livre na forma de ligações de carbono (15,9kJ/40kJ]x100=40%).
Hidrólise pelas lipases
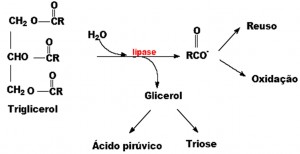
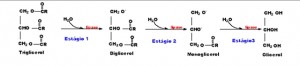
A etapa inicial na conversão de lipídeos a carboidratos é a quebra dos triglicerídeos armazenados nos corpos lipídicos pela enzima lipase, que pelo menos no endosperma da mamona, está localizada na meia membrana que serve como barreira externa do corpo lipídico. Sua atividade está tipicamente associada a membrana e pode ser encontrada em oleossomos, glioxissomos ou frações microssomais, dependendo da espécie. A lipase hidrolisa triacilgliceróis a três moléculas de ácidos graxos e glicerol (Figuras 2 e 3).
Figura 2: Atuação das lípases no metabolismo de triacilgliceróis armazenados nas sementes oleaginosas
Figura 3. Atuação da enzima lipase na hidrólise dos lipídeos, catalisando os três estágios da clivagem hidrolítica das ligações éster dos ácidos graxos em triglicerídeos, com a formação de glicerol e ácidos graxos.
Na figura 3, os estádios 1 e 2 são reversíveis, o 3 é irreversível. Íons de cálcio aceleram a hidrólise dos triglicerídeos porque os ácidos graxos liberados nos estádios 1 e 2 são removidos como sabões de cálcio, tornando-os indisponíveis para reativar ligações ésteres.
As lipases presentes nas sementes diferem quanto ao pH ótimo para a sua atividade, sendo classificadas em lipase ácida com pH ótimo em 4,9, lipase neutra com pH ótimo entre 6 – 7,5 e lipase alcalina com pH ótimo em 9. As lipases neutra e alcalina atuam primeiro, depois a lipase ácida, quando os ácidos graxos livres diminuem o pH do meio. As lipases são enzimas sintetizadas de novo. Na maioria das espécies vegetais, a lipase ativa está ausente em sementes maduras, e aumenta sua atividade durante a germinação e crescimento pós-germinativo, como é o caso das lipases do tomate e da colza. Já em sementes de mamona as lipases estão associadas aos oleossomos no endosperma e seus genes são expressos somente em sementes dormentes antes da germinação, sendo portanto preexistentes.
β-oxidação de ácidos graxos
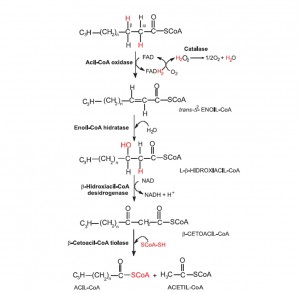
Após a hidrólise dos triacilgliceróis, os ácidos graxos resultantes entram no glioxissomo, onde são ativados pela conversão em graxo-acil-CoA pela enzima sintase do graxo-acil-CoA. Graxo-acil-CoA é o substrato inicial para a série de reações de β-oxidação, nas quais ácidos graxos Cn (ácidos graxos compostos de um número n de carbonos) são sequencialmente quebrados a n/2 moléculas de acetil-CoA. Esta sequência de reações envolve a redução de 1/2 O2 a H2O e a formação de 1 NADH e 1 FADH2 para a cada acetil-CoA produzido. As 4 enzimas envolvidas na β-oxidação estão localizadas exclusivamente nos glioxissomos dos tecidos de reserva (Figuras 4).
Figura 4. Etapas da β-oxidação de ácidos graxos até a liberação do acetil-CoA.
A cada sequência da reação da β-oxidação, ocorre a liberação de Acetil-CoA e de um Acil-CoA, este último volta no inicio sofrendo nova seqüência de reações. Acetil CoA, NADH+, H+, FADH2 e ATP são gerados em cada volta do ciclo de oxidação dos ácidos graxos.
Ciclo do glioxilato
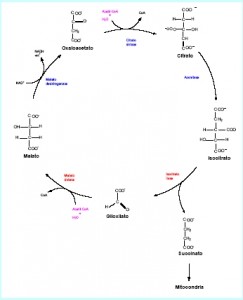
O acetil–CoA produzido na β-oxidação é posteriormente metabolizado nos glioxissomos e citosol por meio de uma série de reações que formam o ciclo do glioxilato. Nesta via metabólica, moléculas de acetil -CoA com duas unidades de carbono são convertidos em uma molécula de quatro carbonos, o succinato (Figura 5).
Figura 5. Esquema simplificado do ciclo de glioxilato.
Em resumo, a cada volta deste ciclo de reações, o acetil-CoA primeiramente reage com o ácido oxalacético, originando citrato que por sua vez é isomerizado a isocitrato. As enzimas envolvidas aqui são a sintetase do citrato e a aconitase, que também catalisam as mesmas reações no Ciclo de Krebs, na mitocôndria. A aconitase não é encontrada no glioxissomo, sendo necessário que o citrato saia dessa organela para o citosol, onde aconitase atua, retornando para o glioxissomo na forma de isocitrato.
O isocitrato, já no glioxissomo, é substrato para a enzima liase do isocitrato, exclusiva desse conjunto de reações, e que catalisa a clivagem de isocitrato em succinato e glioxilato. O succinato sai o glioxissomo para a mitocôndria e o glioxilato é unido a uma molécula de acetil-CoA pela sintase do malato, outra enzima exclusiva desse ciclo, formando malato que é substrato para a desidrogenase do malato que catalisa a síntese de ácido oxalacético.
Dessa maneira, e considerando as enzimas envolvidas no ciclo, pode-se afirmar que o ciclo do glioxilato é uma modificação do ciclo dos ácidos tricarboxilílicos, no qual os passos descarboxilativos foram suprimidos. Na realidade, a liase isocitrato e a sintase malato substituem as enzimas descarboxilativas do ciclo de Krebs, e as outras três enzimas: aconitase, sintase do citrato e desidrogenase do malato são comuns aos dois ciclos em questão.
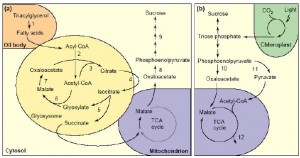
A função do ciclo do glioxilato é, essencialmente, converter duas moléculas de acetil-CoA em succinato, que é transportado para a mitocôndria onde é convertido a malato pelo ciclo de Krebs. O malato sai da mitocôndria para o citosol, e então é oxidado a ácido oxalacético pela desidrogenase do malato citosolica. Este ácido é então convertido a carboidrato pela ação da enzima carboxiquinase do PEP e ATP, formando CO2 e fosfoenolpiruvato, que pode ser convertido a frutose-6-P e depois a sacarose, que é um açúcar translocável que suprirá o embrião em energia (Figura 6). Alguns trabalhos têm demonstrado que durante a germinação de sementes oleaginosas a descarboxilação é suprimida, favorecendo a síntese de carboidratos nos tecidos de reserva das sementes.
O ciclo do glioxilato parece ter estreita relação tanto com a β-oxidação quanto com o ciclo dos ácidos tricarboxílicos. Uma vez que a enzima desidrogenase do malato necessita de NADH+ como cofator para a sua atividade, a liberação de NAD+ na matriz do gliossissomo por essa reação pode ser um dos pontos de regulação da β-oxidação, que produz o NADH+. Por outro lado, este ciclo pode ser anaplerótico (fornecedor) de metabólitos para o ciclo dos ácidos tricarboxilílicos, especialmente quando apenas moléculas de dois carbonos (como o acetil-CoA) estão disponíveis para a respiração. Isso porque, pela natureza irreversível da quinase do piruvato, o piruvato não pode ser convertido a fosfoenolpiruvato (PEP), reprimindo assim a síntese de açúcares solúveis e também de moléculas necessárias à síntese de aminoácidos e bases nitrogenadas. Nessas condições o ciclo do glioxilato funciona suprindo a gliconeogênese com oxalacetado, sem a necessidade da síntese de PEP (Figura 6).
Figura 6. Transição metabólica de (a) heterotrofica para (b) fotoautotrofica em sementes oleaginosas. Os números representam as enzimas:1, lipase; 2, β-oxidação; 3, citrate sintase; 4, aconitase; 5, isocitrato liase; 6, malate sintase; 7, malato desidrogenase; 8, fosfoenolpiruvato carboxiquiinase; 9, gliconeogênese; 10, fosfoenolpiruvato carboxilase; 11, piruvate quinase; 12, rotas de produção de amino ácidos e bases nitrogenadas
O ciclo do glioxilato parece ser regulado pela concentração de açúcares solúveis. Quando a concentração dessas moléculas é elevada, há inibição da expressão genética das enzimas liase do isocitrato e sintase do malato. Contudo, devido a sua função anaplerótica, mesmo em concentração elevada de carboidratos solúveis, o ciclo do glioxilato pode operar, fornecendo esqueleto de carbono principalmente para a síntese de aminoácidos, levando alguns pesquisadores a crer que o funcionamento do ciclo do glioxilato não é unicamente regulado pela concentração de açúcares.
O papel mitocondrial
Ao mover-se dos glioxissomos para as mitocôndrias, o succinato é convertido a malato pelas reações de normais do ciclo de Krebs. O malato resultante pode ser exportado das mitocôndrias em troca pelo succinato, por meio do transportador de dicarboxilatos localizados na membrana mitocondrial interna. O malato é, então, oxidado a oxaloacetato pela desidrogenase do malato no citosol, enquanto o oxaloacetato resultante é convertido a carboidrato.
Essa conversão exige contornar a irreversibilidade da reação da quinase piruvato e é facilitada pela enzima carboxiquinase da PEP , que utiliza a capacidade de fosforilação do ATP para converter oxaloacetao a PEP e CO2. A partir do PEP, a gliconeogênese pode prosseguir com a produção de glicose, conforme já descrito. A sacarose é o produto final deste processo e a forma primária de carbono reduzido translocado dos cotilédones aos tecidos em crescimento das plântulas (Figura 1). Nem todas as sementes convertem gordura em açúcar quantitativamente.
Referências Bibliogáficas:
Buchanan, Gruissem, Jones, Biochemistry & Molecular Biology of Plants p. 696-705. 2000
Taiz, L.; Zeiger, E. Fisiologia vegetal. 5. ed. Porto Alegre: Artmed, 2012. 820 p.
Artigos:
Graham, I. A. Seed Storage Oil Mobilization. Annu. Rev. Plant Biol. 59:115–42, 2008.