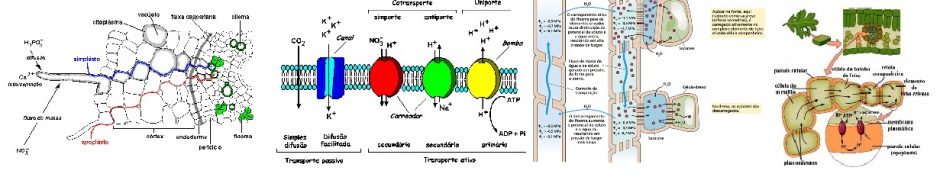
Embora a mitocôndria possua seu próprio DNA, suas funções são muito mais dependentes das proteínas codificadas pelo núcleo do citosol, ao quais são importantes do ciclo do ácido tricarboxílico ou ciclo de Krebs. Este ciclo representa o segundo estádio da respiração e ocorre na matriz mitocondrial. Para iniciar as reações, é necessária a entrada do piruvato que foi formado no citosol através das reações de glicólise, porém a membrana interna da mitocôndria é impermeável ao piruvato, dessa forma, existe um transportador de piruvato (monocarboxilado) que catalisa uma mudança elétrica através da membrana interna resultando em piruvato e OH-.
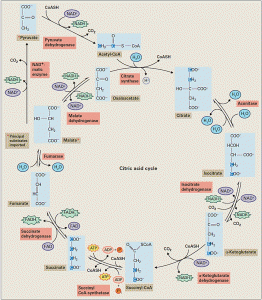
- Uma vez dentro da matriz mitocondrial, o piruvato é descarboxilado oxidativamente pela enzima descarboxilase do piruvato para produzir NADH, CO2 e ácido acético.
- O ácido acético é ligado via uma ligação tioéster a um cofator contendo enxofre, coenzima A (CoA), para formar Acetil CoA.
- A enzima sintase do citrato liga o acetil CoA com o oxalacetato (OAA), um ácido carboxílico de 4 carbonos, para formar um o citrato (ácido tricarboxílico de 6 carbonos).
- O citrato é então isomerizado à isocitrato pela enzima aconitase. As próximas duas reações são sucessivas descarboxilação oxidativas, cada uma delas produzindo um NADH e liberando uma molécula de CO2.
- Produção de succinil-CoA (molécula de 4 carbonos).
- A molécula de succinil-CoA é convertida em succinato pela sintetase do succinil-CoA.
- O succinato resultante é oxidado a fumarato pela desidrogenase do succinato, que é a única enzima associada a membrana do ciclo de Krebs e é considerada como um componente do complexo II da cadeia transportadora de elétrons.
- Os elétrons removidos do succinato são transferidos para outro cofator, o FAD. O FAD é ligado covalentemente ao sítio da desidrogenase do succinato e passa por uma redução reversível de 2 elétrons para produzir FADH2 (FAD + 2 e- + 2 H+). Ao final das duas reações do ciclo do ácido tricarboxílico, fumarato é hidratado para produzir malato.
- O malato é oxidade pela desidrogenase do malato a OAA, produzindo uma molécula de NADH
- O OAA produzido é agora capaz de reagir com outro acetil CoA e continuar o ciclo.
A oxidação do piruvato na mitocôndria dá origem a 3 moléculas de CO2, e muita da energia livre liberada por estas oxidações é armazenada na forma reduzida de NAD+ (4 NADH) e FAD (1 FADH2). Em adição uma molécula de ATP é produzida pela fosforilação ao nível de substrato durante o ciclo Krebs.
Figura 1. As reações do ciclo do ácido cítrico (Buchanan et al., 2015)
- Formação do citrato
A primeira reação do ciclo é a condensação do acetil-CoA com o oxaloacetato para formar citrato, catalisado pela sintase do citrato: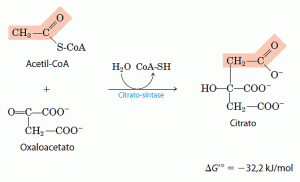 Nessa reação, o carbono metila do grupo acetil é reunido ao grupo carbonila (C-2) do oxaloacetato. O intermediário citroil-CoA é transitório; ele é formado no sítio ativo da enzima e rapidamente hidrolisado, liberando o citrato e a CoA livre, estes últimos abandonam o sítio ativo. A hidrólise do tioéster intermediário de alta energia faz com que a reação seja altamente exergônica nesse sentido. A variação de energia livre negativa e de grande valor absoluto, associada com a reação da sintase do citrato, é essencial para a operação do ciclo, isso porque, normalmente, a concentração de oxaloacetato presente é muito baixa. A CoA deixada livre nessa reação é reciclada, podendo participar na descarboxilação oxidativa de outra molécula de piruvato pelo complexo da desidrogenase do piruvato.
Nessa reação, o carbono metila do grupo acetil é reunido ao grupo carbonila (C-2) do oxaloacetato. O intermediário citroil-CoA é transitório; ele é formado no sítio ativo da enzima e rapidamente hidrolisado, liberando o citrato e a CoA livre, estes últimos abandonam o sítio ativo. A hidrólise do tioéster intermediário de alta energia faz com que a reação seja altamente exergônica nesse sentido. A variação de energia livre negativa e de grande valor absoluto, associada com a reação da sintase do citrato, é essencial para a operação do ciclo, isso porque, normalmente, a concentração de oxaloacetato presente é muito baixa. A CoA deixada livre nessa reação é reciclada, podendo participar na descarboxilação oxidativa de outra molécula de piruvato pelo complexo da desidrogenase do piruvato.
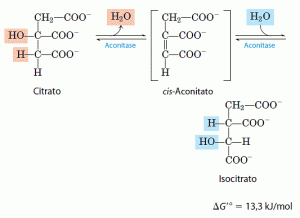
- Formação do isocitrato via cis-aconitato
A enzima aconitase catalisa a transformação reversível do citrato em isocitrato, por meio da formação intermediária do cis-aconitato, um ácido tricarboxílico que, normalmente, não se dissocia do sítio ativo. A aconitase pode promover a adição reversível de água na dupla ligação do cis-aconitato ligado no sítio catalítico da enzima por dois caminhos diferentes, um levando a citrato e o outro a isocitrato:
Embora a mistura em equilíbrio em pH 7,4 e 25°C contenha menos que 10% de isocitrato, na célula a reação é desloca da para a direita, porque o isocitrato é rapidamente consumido no passo subseqüente do ciclo, diminuindo a concentração de equilíbrio estacionário. A aconitase contém um centro ferro-enxofre que atua tanto na ligação do substrato no sítio ativo quanto na catálise da adição ou remoção de água.
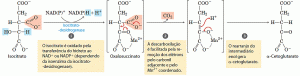
- Oxidação do isocitrato a α-cetoglutarato
No passo seguinte, a desidrogenase do isocitrato catalisa a descarboxilação oxidativa do isocitrato para formar o α-cetoglutarato. O Mn2+ no sítio ativo interage com o grupo carbonila do produto intermediário, o oxalossuccinato, que é formado de forma transitória mas não abandona o sítio de ligação até que a descarboxilação o converte em α-cetoglutarato. O Mn2+ também estabiliza o enol formado transitoriamente pela descarboxilação:
Nas células existem duas formas diferentes da desidrogenase isocítrica, uma que emprega o NAD+ como receptor de elétrons e outra que emprega o NADP+. A reação global catalisada pelas duas isoenzimas é idêntica nos demais aspectos. Nas células eucarióticas, a enzima dependente de NAD é encontrada na matriz mitocondrial e atua no ciclo do ácido cítrico. A isoenzima dependente de NADP é encontrada tanto na matriz mitocondrial quanto no citosol e sua função mais importante deve ser a geração de NADPH, que é essencial nas reações anabólicas de redução.
- Oxidação do α-cetoglutarato a succinil-CoA e CO2
O passo seguinte é outra descarboxilação oxidativa, nela o α-cetoglutarato é convertido em succinil-CoA e CO2 pela ação do complexo da desidrogenase do α-cetoglutarato e o NAD+ serve como receptor de elétrons e o CoA como carreador do grupo succinil. A energia de oxidação do α-cetoglutarato é conservada pela formação de uma ligação tioéster do succinil-CoA: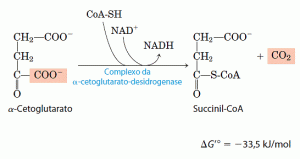 Essa reação é virtualmente idêntica à reação da desidrogenase do piruvato e o complexo da desidrogenase do α-cetoglutarato assemelha-se em estrutura e em função ao complexo da desidrogenase do piruvato. Além das três enzimas análogas a E1′ E2 e E3 do complexo da desidrogenase do piruvato, ele inclue também TPP ligado à enzima, lipoato, FAD, NAD e coenzima A ligados às proteínas. Ambos os complexos devem ser derivados de um mesmo ancestral evolucionário. Embora a E1 do complexo da desidrogenase do α-cetoglutarato seja estruturalmente similar à E1 da desidrogenase do piruvato, suas sequências de aminoácidos são diferentes e têm especificidades de ligação diferentes: os componentes E1 do complexo da desidrogenase do piruvato ligam-se especificamente ao piruvato, enquanto E1 do complexo da desidrogenase do α-cetoglutarato liga-se ao α-cetoglutarato. Os componentes E2 dos dois complexos são muito similares, ambos incluem partes de lipoil ligadas de forma covalente. As subunidades de E3 são idênticas nos dois complexos enzimáticos.
Essa reação é virtualmente idêntica à reação da desidrogenase do piruvato e o complexo da desidrogenase do α-cetoglutarato assemelha-se em estrutura e em função ao complexo da desidrogenase do piruvato. Além das três enzimas análogas a E1′ E2 e E3 do complexo da desidrogenase do piruvato, ele inclue também TPP ligado à enzima, lipoato, FAD, NAD e coenzima A ligados às proteínas. Ambos os complexos devem ser derivados de um mesmo ancestral evolucionário. Embora a E1 do complexo da desidrogenase do α-cetoglutarato seja estruturalmente similar à E1 da desidrogenase do piruvato, suas sequências de aminoácidos são diferentes e têm especificidades de ligação diferentes: os componentes E1 do complexo da desidrogenase do piruvato ligam-se especificamente ao piruvato, enquanto E1 do complexo da desidrogenase do α-cetoglutarato liga-se ao α-cetoglutarato. Os componentes E2 dos dois complexos são muito similares, ambos incluem partes de lipoil ligadas de forma covalente. As subunidades de E3 são idênticas nos dois complexos enzimáticos.
- Conversão da succinil-CoA em succinato
Como o acetil-CoA, o succinil-CoA tem uma energia livre-padrão de da hidrólise de sua ligação tioéster forte e negativa (ΔG’ = -36 kJ/mol). No próximo passo do ciclo de Krebs, a energia liberada no rompimento dessa ligação é empregada para dirigir a síntese de uma ligação de anidrido fosfórico , com uma ΔG’ de apenas -2,9kJ/mol. No processo, é formado o succinato: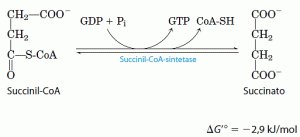 A enzima que catalisa essa reação reversível é chamada de sintetase do succinil-CoA, o que indica a participação de um nucleosídio trifosfato na reação. Essa reação conservadora de energia envolve um passo intermediário no qual a molécula da enzima é fosforilada em um resíduo de histidina específico presente no sítio ativo. Esse grupo fosforila, que tem um alto potencial de transferência de grupo, é transferido para o ADP com a formação de ATP. A síntese de ATP às expensas da energia liberada pela descarboxilação oxidativa do α-cetoglutarato é outro exemplo de fosforilação ao nível do substrato, como a sintese de ATP acoplada às reações na glicólise catalisadas pelas enzimas desidrogenase do gliceraldeído 3-fosfato e quinase do piruvato. Assim, o resultado final da atividade de qualquer isoenzima da sintetase do succinil-CoA é a conservação da energia na forma de ATP.
A enzima que catalisa essa reação reversível é chamada de sintetase do succinil-CoA, o que indica a participação de um nucleosídio trifosfato na reação. Essa reação conservadora de energia envolve um passo intermediário no qual a molécula da enzima é fosforilada em um resíduo de histidina específico presente no sítio ativo. Esse grupo fosforila, que tem um alto potencial de transferência de grupo, é transferido para o ADP com a formação de ATP. A síntese de ATP às expensas da energia liberada pela descarboxilação oxidativa do α-cetoglutarato é outro exemplo de fosforilação ao nível do substrato, como a sintese de ATP acoplada às reações na glicólise catalisadas pelas enzimas desidrogenase do gliceraldeído 3-fosfato e quinase do piruvato. Assim, o resultado final da atividade de qualquer isoenzima da sintetase do succinil-CoA é a conservação da energia na forma de ATP.
- Oxidação do succinato a fumarato
O succinato formado a partir do succinil-CoA é oxidado a fumarato pela enzima desidrogenase do succinato: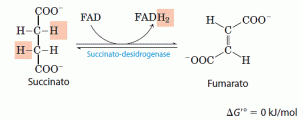 Nos eucariotos, a desidrogenase do succinato é firmemente ligada à membrana mitocondrial interna, no entanto, em procariotos ela se liga à membrana plasmática. A enzima contém três diferentes agrupamentos ferro-enxofre e uma molécula de FAD da de forma covalente. Os elétrons retirados do succinato passam através do FAD e dos centros ferro-enxofre antes de entrarem na cadeia transportadora de eletróns na membrana mitocondrial interna (ou na membrana plasmática das bactérias). O fluxo de elétrons do succinato até o O2, o receptor final de elétrons, através desses transportadores, está acoplado à síntese de 1,5 molécula de ATP por par de elétrons (fosforilação ligada à respiração).
Nos eucariotos, a desidrogenase do succinato é firmemente ligada à membrana mitocondrial interna, no entanto, em procariotos ela se liga à membrana plasmática. A enzima contém três diferentes agrupamentos ferro-enxofre e uma molécula de FAD da de forma covalente. Os elétrons retirados do succinato passam através do FAD e dos centros ferro-enxofre antes de entrarem na cadeia transportadora de eletróns na membrana mitocondrial interna (ou na membrana plasmática das bactérias). O fluxo de elétrons do succinato até o O2, o receptor final de elétrons, através desses transportadores, está acoplado à síntese de 1,5 molécula de ATP por par de elétrons (fosforilação ligada à respiração).
- Hidratação do fumarato produz malato
A hidratação reversível do fumarato em L-malato é catalisada pela fumarase. O intermediário no estado de transição dessa reação é um carbaníon: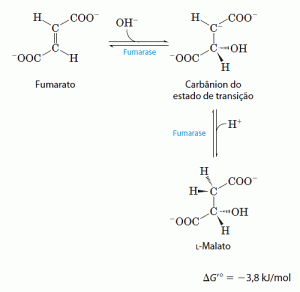 Essa enzima é altamente estereoespecífica e catalisa a hidratação da dupla ligação trans do fumarato, porém não é capaz de agir no malato (o isômero cis do fumarato). Na direção inversa (de L-malato para fumarato), a fumarase é igualmente estereoespecífica: o D-malato não é um substrato.
Essa enzima é altamente estereoespecífica e catalisa a hidratação da dupla ligação trans do fumarato, porém não é capaz de agir no malato (o isômero cis do fumarato). Na direção inversa (de L-malato para fumarato), a fumarase é igualmente estereoespecífica: o D-malato não é um substrato.
- A oxidação do malato a oxaloacetato
Na ultima reação do ciclo de Krebs a desidrogenase do malato, ligada ao NAD, catalisa a oxidação do malato em oxalocatato: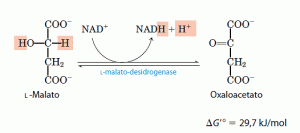 O equilíbrio dessa reação está muito deslocado para a esquerda sob as condições termodinâmicas padrão, mas, nas células intactas, o oxaloacetato é continuamente removido pela reação da sintase do citrato que é altamente exergônica. Isso conserva a concentração do oxaloacetato na célula em valores extremamente pequenos, deslocando a reação da desidrogenase do malato na direção de formação de oxaloacetato.
O equilíbrio dessa reação está muito deslocado para a esquerda sob as condições termodinâmicas padrão, mas, nas células intactas, o oxaloacetato é continuamente removido pela reação da sintase do citrato que é altamente exergônica. Isso conserva a concentração do oxaloacetato na célula em valores extremamente pequenos, deslocando a reação da desidrogenase do malato na direção de formação de oxaloacetato.
Embora as reações individuais do ciclo do ácido cítrico tenham sido inicialmente estudadas in vitro, tendo como material de trabalho extratos de tecido muscular macerado, tanto a via como sua regulação também foram extensivamente estudas in vivo. Pelo emprego de precursores marcados radioativamente, como, por exemplo, [14 C] piruvato e [14 C] acetato, os pesquisadores podem acompanhar o destino individual de cada átomo de carbono por meio do ciclo de Krebs.
O ciclo do ácido cítrico tem um papel central nos mecanismos metabólicos de obtenção e preservação de energia, no entanto, seu papel não está limitado a esses processos. Intermediários com quatro e cinco átomos de carbono do ciclo são empregados como precursores biossintéticos de uma grande variedade de substâncias. Para substituir as moléculas desses intermediários removidos com esse propósito, as células empregam as reações anapleróticas.
Veja também:
Regulação e Inibição do Ciclo de Krebs
- Referências Bibliográficas:
Buchanan, B. B.; Gruissem,w.; Jones, R. L. Biochemistry e Molecular Biology of Plants. 2. Ed. Chichester: Wiley-Blackwell, 2015. 1283p
Lehninger, A. L.; Nelson, D. L.; Cox, M. M. Princípios da Bioquímica de Lehninger. 6. Ed. Porto Alegre: Artmed, 2014. 425p.
Taiz, L.; Zeiger, E.; Moller, L. M.; Murfhy, A. Fisiologia e desenvolvimento vegetal. 6. Ed. Artmed, 2017. 528 p.