Sob condições normais, a fotofosforilação requer fluxo de elétrons, embora sob certas condições o fluxo de elétrons e a fotofosforilação possam ocorrer independentemente. O fluxo de elétrons sem o acompanhamento da fosforilação é dito desacoplado. Sabe-se que a fotofosforilação funciona via mecanismo quimiosmótico. o mesmo tipo de mecanismo aciona a fosforilação durante a respiração aeróbica em bactérias e na mitocôndria, bem como a transferência de muitos íons e metabólitos através de membranas. A quimiosmose parece ser um aspecto unificador dos processos de membrana em todas as formas de vida.
O princípio básico da quimiosmose é que as diferenças na concentração de íons e as diferenças no potencial elétrico através das membranas são uma fonte de energia libre que pode ser utilizada pela célula. Qualquer distribuição não uniforme de matéria ou energia representa uma fonte de energia. As diferenças no potencial químico de qualquer espécie molecular cujas concentrações não são as mesmas em lados opostos de uma membrana fornecem tal fonte de energia. A direção da translocação de prótons é tal que o estroma torna-se mais alcalino e o lume mais ácido, como resultado do transporte de elétrons.
Algumas das primeiras evidências respaldando o mecanismo quimiosmótico da formação fotossintética de ATP foi fornecida pelo ensaio de Jagendorf e colaboradores, onde eles colocaram tilacóides de cloroplastos em uma suspensão tampão de pH 4 e o tampão difundiu através da membrana, causando um equilíbrio neste pH ácido entre o interior e o exterior do tilacóide. Eles então transferiram os tilacóides para um tampão de pH 8, criando assim, uma diferença de pH de 4 unidades através da membrana do tilacóide, com o interior mais ácido do que o exterior.
Foi verificado que grandes quantidades de ATP eram formadas a partir de ADP + Pi por meio desse processo, sem a entrada de luz ou transporte de elétrons. o resultado dá suporte às predições da hipótese quimiosmótica (Figura 1).
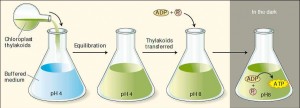
Figura 1. Experimento de Jagendorf: Os tilacóides isolados de cloroplastos e mantidos previamente em pH 8 são equilibrados em um meio ácido em pH 4. Os tilacóides são então transferidos para um tampão em pH 8 contendo ADP e Pi. O gradiente de prótons gerado por esta manipulação forneceu uma força propulsora para a síntese de ATP na ausência de luz. Isso confirma a teoria quimiosmótica, onde um potencial químico através da membrana pode fornecer energia para a síntese de ATP.
Toda a energia disponível para a síntese de ATP, chamado de força motora de prótons (∆p), é a soma de um potencial químico de prótons e o potencial elétrico transmembrana. Esses dois componentes da força motora de prótons do lado de fora da membrana par o interior são dados pela seguinte equação:
∆p = ∆E – 59(pHi – pHo)
onde ∆E é o potencial elétrico transmembrana e pHi – pHo, a diferença de pH através da membrana. A constante de proporcionalidade (a 25°C) é 59mV por unidade de pH, de forma que uma diferença transmembrana de 1 unidade de pH é equivalente a um potencial de membrana de 59mV.
Sob condições de equilíbrio dinâmico do transporte de elétrons nos cloroplastos, o potencial elétrico da membrana é bastante pequeno devido ao movimento de íons na membrana, de modo que ∆p é formado quase exclusivamente pela variação de pH. A estequiometria de prótons translocados por ATP sintetizado foi recentemente calculada em quatro H+ íons por ATP.
O complexo da ATPase possui uma porção periférica (Cf1), responsável por catalisar a produção da molécula de ATP e por uma porção associada à membrana do tilacóide (Cfo) que trata-se de um poro para a passagem de prótons do lúmen para o estroma (Figura 2).
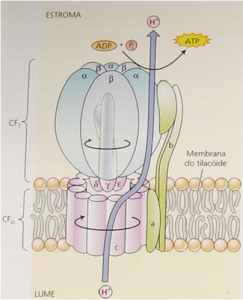
Figura 2. Complexo ATPase responsável pela produção de ATP a partir de mecanismo quimiosmótico.
O movimento de prótons através do Cfo, promove o giro de Cf1 para a produção de ATP. No sítio O, há entrada de ADP+Pi, no sítio L passagem de ADP+Pi, no sítio T ocorre a formação de ATP e no sítio O, finalmente o ATP é liberado (Figura 3).
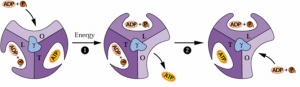 FIGURA 3. O modelo de Boyer. As subunidades α e β configuram três lados do nucleotídeo: O, que promove a ligação precoce para ADP e fosfato inorgânico, L, para o qual o ADP e o fosfato inorgânico ligam após migrar de O, e T, que liga ATP. Energia resultando do movimento de prótons do lúmen do cloroplasto para o estroma dirige a rotação da subunidade γ do CF1, e a interconversão dos lados de ligação e originam a molécula de ATP.
FIGURA 3. O modelo de Boyer. As subunidades α e β configuram três lados do nucleotídeo: O, que promove a ligação precoce para ADP e fosfato inorgânico, L, para o qual o ADP e o fosfato inorgânico ligam após migrar de O, e T, que liga ATP. Energia resultando do movimento de prótons do lúmen do cloroplasto para o estroma dirige a rotação da subunidade γ do CF1, e a interconversão dos lados de ligação e originam a molécula de ATP.
