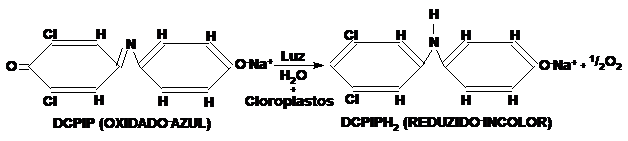Formação do Poder Redutor por Cloroplastos Isolados (Reação de Hill); Demonstração da produção de ATP, segundo Teoria Quimiosmótica (Bomba de prótons); Inibidores fotoquímicos (herbicidas)
OBJETIVO: Demonstrar a produção de poder redutor e de ATP em cloroplastos isolados e fornecer informações sobre a inibição das reações fotoquímicas por herbicidas.
INTRODUÇÃO
A redução de CO2 a carboidratos depende primariamente do poder redutor gerado pelo aproveitamento da energia luminosa no sistema fotoquímico dos cloroplastos. Na planta o poder redutor fotossíntetico é formado pela produção de NADPH a partir de H2O, NADP+ e luz. Desde que cloroplastos sejam submetidos a condições ótimas também produzem este cofator. Isto foi descoberto por Hill quando, em 1937, ele observou que cloroplastos iluminados produziam oxigênio pela redução de várias substâncias oxidantes como íon ferricianeto, quinonas e compostos coloridos. Diversas substâncias oxidantes coloridas (receptoras de elétrons) conseguem detectar baixos níveis de atividade de Hill como por exemplo o 2,6- diclorofenol-indofenol (DCPIP). O DCPIP é um reagente artificial de Hill, que quando adicionado a uma suspensão de cloroplastídeos e na presença de luz capta os elétrons do sistema fotoquímico, reduzindo-se a DCPIPH2. O DCPIP é utilizado para demonstrar que é realmente nas reações fotoquímicas que se forma o poder redutor (NADPH) utilizado na redução do CO2 a açúcar durante a fase química (“escura”) da fotossíntese.
FORMAÇÃO DO PODER REDUTOR (ARTIFICIAL)
(Esquema mostrando o processo de fotoredução do DCPIP, que pode ser avaliado em comprimento de onda de 600 nanômetros e tambem visivel a olho nú)
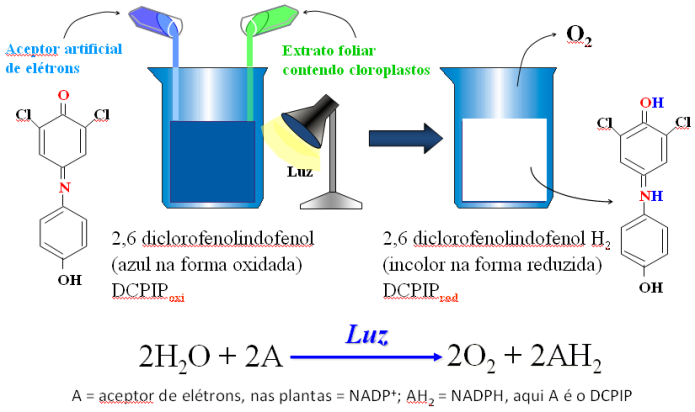
O ácido ascórbico é uma substância reduzida que, na presença de um agente oxidante (DCPIP) se oxida a ácido dihidroascórbico e promove a redução do agente oxidante.
(A transferencia de eletrons ocorre de uma substancia de potencial redox (E`0) menor para outra de potencial redox (E`0) maior)
EFEITO DE HERBICIDAS NA FOTOQUIMICA
(Esquema mostrando a estrutura química dos principais bloqueadores (A) da cadeia transportadora de elétrons (B) dentro da etapa fotoquímica da fotossíntese. Adaptado de Blankenship, 2010)

FORMAÇÃO DO PODER REDUTOR (NATURAL) – (REAÇÃO DE HILL)
2NADP+ + 2H2O —————> 2 NADPH + 2H+ + O2
CLOROPLASTOS
O modo de ação de muitos inibidores metabólicos (herbicidas) está relacionado com o bloqueio das reações fotoquímicas da fotossíntese, como pode ser visto na figura 4. A inibição da fotossíntese é um dos efeitos mais espetaculares realizados pelos herbicidas visto que atuam sobre um mecanismo que não existe no organismo humano e animal. Compostos herbicidas do tipo triazina (atrazina, prometrina, prometron, etc.) assim como os derivados da uréia (diurom, fluometuron e linuron) são fortes inibidores das reações fotoquímicas da fotossíntese.
METODOLOGIA
1º. Preparação da suspensão de cloroplastos:
Homogeiniza 20 gramas de folhas de fumo em 100 ml de solução congelada, 0,4 M de sacarose em tampão fosfato, 0,1M pH 6,8 durante um minuto. Filtre o homogenado através de 4 camadas de muscelina ou tela de nylon aparando o filtrado em bequer contido em recipientte com gelo. Centrifugue o filtrado a uma rotação de 200 g por 1 minuto. Tome o sobrenadante e centrifugue-o por 10 minutos a 1000 g. Despreze o sobrenadante e re-suspenda e dilua o precipitado em solução de sacarose 0,4M tampo
ATENÇÃO: Todo material a ser utilizado (vidraria, bequeres, tubos de ensaio, tubos de centrífugas) deve ser previamente esfriado em congelador.
2º. Tome 4 tubos de ensaio pequenos, colocando em três deles 0,1 ml da suspensão de cloroplastos e no quarto 0,5 ml da solução de DCPIP (2,5 mM). No primeiro tubo adicione 2,0 ml de água destilada. No segundo e terceiro tubos adicione 2,0 ml da solução do DCPIP, envolvendo o segundo tubo em papel de alumínio. Exponha o conjunto a uma fonte luminosa. Adicione ao quarto tubo um cristal de ácido ascórbico; observe o que ocorre. Após 10-20 minutos, observe os 3 primeiros tubos; ao tubo envolto em papel de alumínio, adicione um cristal de ácido ascórbico. Registre a ocorrência.
QUESTIONÁRIO:
- O que é Reação de Hill?
- Por que o NADP+ é considerado como um oxidante natural de Hill?
- Qual o papel ácido ascórbico nessa experiência, levando em consideração os potenciais redox do DCPIP (E`= 0,2V) e do ácido ascórbico (E`= 0,0V)?
- Mencione pelo menos 3 produtos comerciais utilizados como herbicidas, citando seus princípios ativos e modo de ação na fotossíntese.
- Qual é o papel da luz e dos cloroplastos na descoloração do DCPIP?
- Por que é necessário o uso de temperaturas baixas durante o preparo da suspensão dos cloroplastos?
- Por que a solução de DCPIP descolore após adição do ácido ascórbico?
- Explique o que ocorreu em cada tubo.
- A utilização de oxidantes artificiais de Hill permite detectar a ocorrência da “reações fotoquímicas”, mas impede que ocorram as reações de “fixação do CO2”. Explique por que isso acontece.
- O que aconteceu ao envolver o tubo número 3 com papel alumínio.
- Como foi realizado o experimento de Jagendorf demonstrando a produção de ATP segundo a Teoria Quimiosmótica (Bomba de Prótons)
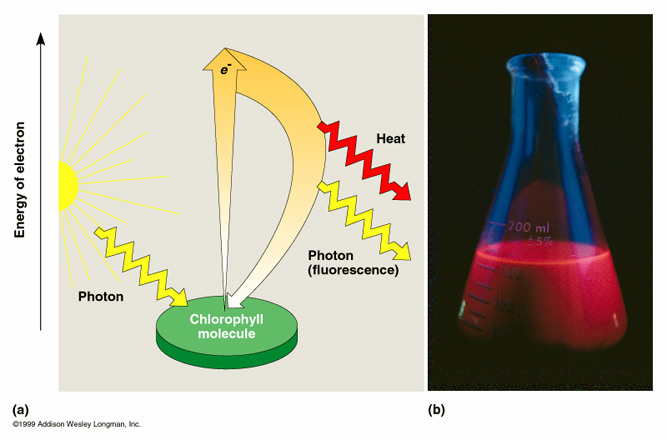
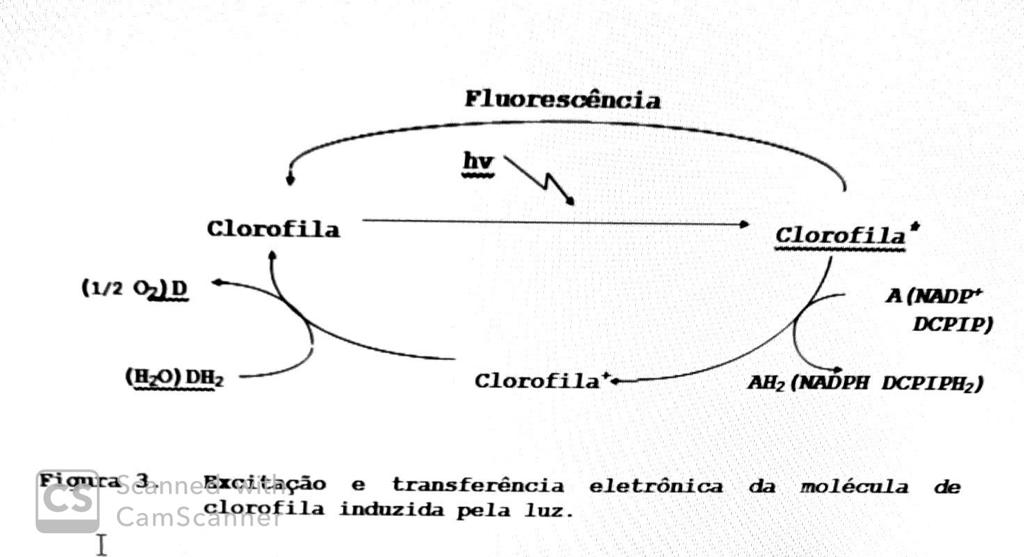
Fluorescência e excitação e transferência eletrônica da molécula de clorofila induzida pela luz.
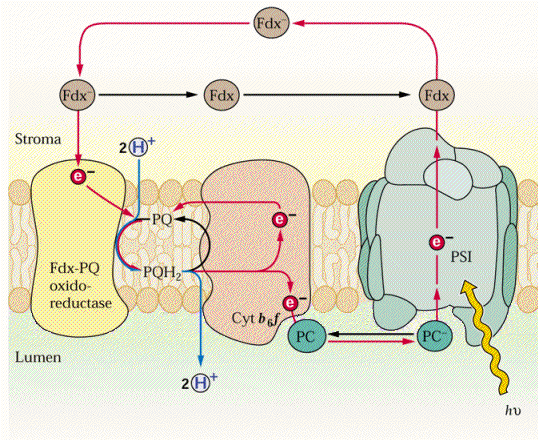
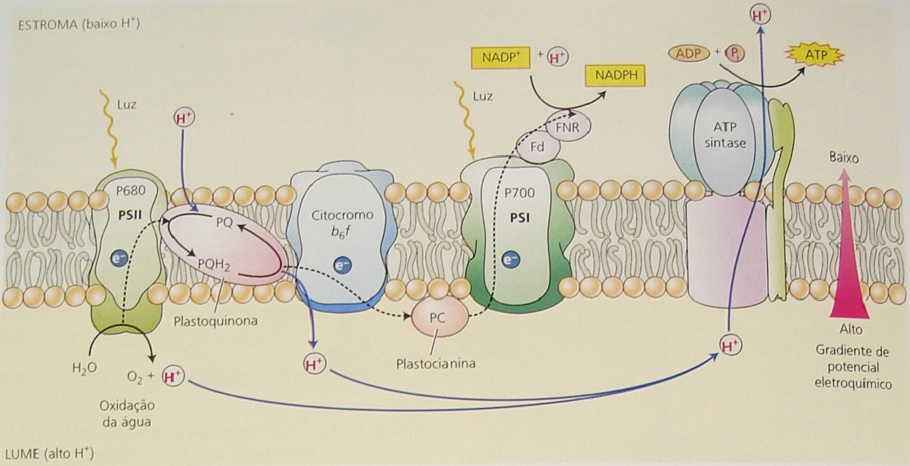
 Formação de ATP (fotofosforilação cíclica e acíclica) pela Bomba de Prótons e de poder redutor (NADPH) durante as reações fotoquímicas da fotossíntese.
Formação de ATP (fotofosforilação cíclica e acíclica) pela Bomba de Prótons e de poder redutor (NADPH) durante as reações fotoquímicas da fotossíntese.
FOTOFOSFORILAÇÃO ACÍCLICA E PRODUÇÃO DE NADPH:
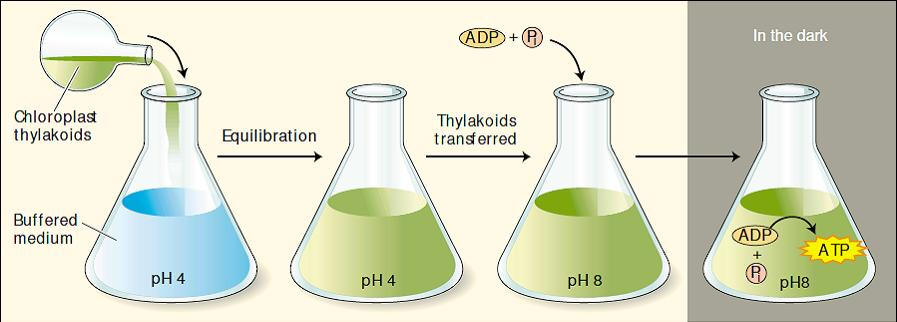
Demostração do Mecanismo quimiosmótico (Bomba de prótons) da produção de ATP durante a fotoquimica
Foi verificado que grandes quantidades de ATP eram formadas a partir de ADP + Pi por meio desse processo, sem a entrada de luz ou transporte de elétrons. o resultado dá suporte às predições da hipótese quimiosmótica . Na figura seguir esta esta demonstração conhecida como “Experimento de Jagendorf”.
Neste experimento os tilacóides isolados de cloroplastos e mantidos previamente em pH 8 são equilibrados em um meio ácido em pH 4. Os tilacóides são então transferidos para um tampão em pH 8 contendo ADP e Pi. O gradiente de prótons gerado por esta manipulação forneceu uma força propulsora para a síntese de ATP na ausência de luz. Isso confirma a teoria quimiosmótica, onde um potencial químico através da membrana pode fornecer energia para a síntese de ATP.