A enzima ribulose-1,5-bisfosfato carboxilase / oxigenase, mais comumente conhecida por RuBisCO é utilizada no ciclo de Calvin para catalisar o primeiro grande passo de fixação de carbono. A RuBisCO é a proteína mais abundante no mundo (PARRY et al., 2008).
A RuBisCO catalisa tanto a carboxilação ou oxigenação da ribulose-1,5-bifosfato com dióxido de carbono ou oxigênio. RuBisCO tem um peso molecular de 490.000 Daltons e é composta por oito subunidades grandes e oito subunidades pequenas. As subunidades grandes são codificados no cloroplasto em si, enquanto as pequenas unidades são codificadas no núcleo da célula (PARRY et al., 2008)
A atividade da Rubisco é determinada pela quantidade de proteína que, por sua vez, é determinada pela a taxa relativa de biossíntese e degradação. Estes processos são regulados pela expressão do gene do mRNA, síntese polipeptídica, modificações pós-transducionais e montagem das subunidades em uma holoenzima ativa, e vários outros fatores que influenciam sobre a degradação protéica (PARRY et al., 2008).
A Rubisco tem baixo turnover em relação às outras enzimas envolvidas no ciclo de Calvin e por isso é requerida em grandes quantidades para suprir a fotossíntese, dessa maneira é necessário que haja não só uma grande disponibilidade de substrato (CO2), mas também grandes quantidades de Rubisco para atender a fotossíntese (PARRY et al., 2008).
REGULAÇÃO DA RUBISCO
A Rubisco é regulada por uma enzima chamda Rubisco ativase essencial para a ativação e manutenção da atividade catalítica da Rubisco, promovendo a remoção de qualquer inibidor. A Rubisco ativase deve interagir diretamente com a Rubisco para alterar a estrutura da enzima, tornando o sítio ativo acessível para a carbamilação (PARRY et al., 2008).
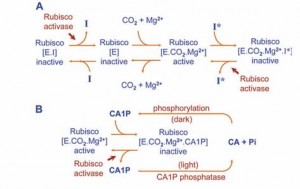
A Rubisco ativase (E) in vivo é modulada tanto pela carbamilação de um resíduo de lisina no sítio catalítico e posterior estabilização do carbamato resultante da formação de um complexo ternário cataliticamente ativo com a presena do íon de Mg++ (E.CO2.Mg++). O CO2 envolvido no sítio ativo é distinto do CO2 que reage com a molécula receptora, RuBP, durante a catálise. Inibidores podem estar presentes tanto antes (EI) ou após a carbamilação (E.CO2.Mg++. I) e bloquear o sítio ativo da enzima, impedindo a carbamilação. A remoção da forte ligação dos inibidores ao sítio catalítico das formas carbamilada e descarbamilada da Rubisco requer a Rubisco ativase e hidrólise de ATP. Desta forma, a Rubisco ativase garante que o sítio ativo da Rubisco não seja bloqueada por inibidores e se torne livre, para se tornar carbamilada ou para participar diretamente na catálise (PARRY et al., 2008).
A CA1P é um dos inibidores da Rubisco.e só é encontrada no cloroplasto, sendo formada por fosforilação. de 2-carboxi-D-arabinitol (CA) (síntese de CA1P) durante os períodos baixa irradiância ou escuro. Uma vez formada a CA1P vincula fortemente ao sítio ativo da Rubisco carbamilada (PARRY et al., 2008).
Figura 1. (A) Princípios de regulação da Rubisco ativase. [E] enzima, não modificada, [EI] enzima, descarbamilada com substrato (RuBP) com compostos inibidores ligados a sítios ativos (I); [E. CO2.Mg++.] Complexo ternário ativo [E. CO 2+ Mg++I], a enzima carbamilada com sítio catalítico ocupado por inibidor de forte ligação (CA1P, PDBP e possivelmente KABP). (B) inibição reversível da Rubisco carbamilada pelo CA1P, na ausência de luz, mostrando a fosforilação de CA1P e na presença de luz ocorre a desfosforilação onde a Rubisco Ativase ocupa o sítio ativo da Rubisco (Fonte: Parry et al., 2008).
Por razões que ainda não são claras, a quantidade de CA1P que acumula durante a noite varia de espécie para espécie. Embora muitas espécies (arroz, soja, batata, fumo, feijão e tomate) contenham quantidade suficiente de CA1P, enquanto outras culturas como (milho e trigo) não possuem (PARRY et al., 2008).
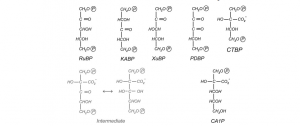
O inibidor pentadiulose 1,5-bifosfato (PdBp) é formado pela eliminação de H2O2. O PdBp é acumulado progressivamente no sítio catalítico, causando a inibição progressiva. Portanto, quaisquer condições que favorecem a oxigenase (fotorrespiração), como o fechamento estomático (aumentando O2/CO2) e alta temperatura diminui a especificidade da Rubisco levando a um aumento da produção de PdBp (PARRY et al., 2008).
Figura 2. Estruturas de ocorrência natural de inibidores da Rubisco. RuBP, ribulose-1,5-bifosfato;KABP,3-ketoarabinitol-1,5-bifosfato;XuBP,D-Xilulose-1,5-bifosfato; PDBP,D-glicero-2,3 pentodiulose-1,5- bifosfato; CTBP,2-carboxytetritol-1,4-ifosfato; CA1P, 2-carboxi-D-arabinitol 1-fosfato.