INIBIDORES DA FOSFORILAÇÃO OXIDATIVA
Muita informação a respeito da cadeia respiratória foi obtida pela utilização de inibidores, e, reciprocamente, esclareceu o mecanismo de ação de diversos inibidores. Para fins descritivos, eles podem ser divididos em três grupos:
- inibidores da cadeia respiratória
- inibidores da fosforilação oxidativa propriamente dita
- desacopladores da fosforilação oxidativa.
a) Inibidores da cadeia respiratória:
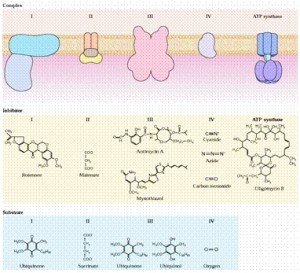
Os inibidores que paralisam a respiração pelo bloqueio da cadeia respiratória atuam em três locais. O primeiro é o inibido pelos barbituratos tal como o amobarbital, pelo antibiótico piericidina A e pelo inseticida e veneno de peixes rotenona. Esses inibidores impedem a oxidação de substratos que se comunicam diretamente com a cadeia respiratória, via uma desidrogenase dependente de NAD, por bloquear a transferência de elétrons do FeS até a CoQ. Atuam portanto no complexo I da cadeia transportadora de elétrons.
| Complexo | Inibidores |
| I | Barbituratos (hipnóticos)
Rotenona (inseticida) Piericidina A |
| II |
2-tenoiltrofluoroacetona carboxina malonato (inibidor competitivo) |
| III |
Antimicina A Dimercaprol |
| IV |
Cianeto, monóxido de carbono azida sódica ácido sulfídrico |
A 2-Tenoiltrofluoroacetona e carboxina e seus derivados bloqueiam especificamente o complexo II, a redutase do succinato-UQ. O malonato é um inibidor competitivo da redutase do succinato-UQ. Essas drogas impedem a oxidação do FADH2.
A antimicina e o Dimercaprol inibem a cadeia respiratória impedindo o fluxo de elétrons entre os citocromos “b” e “c”. A Antimicina é um antibiótico produzido pelo fungo Streptomyces griseus, e inibe especificamente a enzima redutase do UQ-citocromo c, impedindo o conseqüente fluxo de elétrons.
O complexo IV, oxidase do citocromo c é especificamente inibida pelo cianeto, azida e monóxido de carbono. Cianeto e azida ligam-se fracamente à forma férrica do citocromo a3, enquanto monóxido de carbono liga-se apenas à forma ferrosa. As ações inibidoras do cianeto e da azida neste sítio são muito potentes, enquanto a principal toxicidade do monóxido de carbono reside na sua afinidade pelo ferro da hemoglobina. Sabendo-se que os animais carregam muitas moléculas de hemoglobina, eles precisam inalar uma quantidade muito grande de monóxido de carbono para morrer. Estes mesmos organismos, contudo, possuem comparativamente poucas moléculas de citocromo a3. Consequentemente, uma exposição limitada ao cianeto pode ser letal. Essa ação repentina do cianeto atesta para uma constante e imediata necessidade do organismo pela energia suprida pelo transporte de elétrons.
b) Inibidores da síntese de ATP:
Os inibidores da síntese de ATP atuam diretamente sobre a partícula FoF1 e sua correspondente ATP sintase. O diciclohexilcarbodimida (DCCD) liga-se covalentemente aos grupos carboxila em domínios hidrofóbicos de proteínas em geral, e a um resíduo de ácido glutâmico da subunidade c do Fo, o polipeptídeo que forma o canal de prótons da ATP sintase, em particular. Se a subunidade c é marcada com DCCD, o fluxo de prótons é bloqueado e a atividade da ATP sintase é inibida.
Semelhantemente ao DCCD, a oligomicina age diretamente na ATP sintase. Pela ligação à uma subunidade de Fo e dessa forma a oligomicina também bloqueia o movimento de prótons através desse canal.
O atractilosídeo também inibe a síntese de ATP porém de forma diferente. A fosforilação oxidativa depende do transporte de nucleotídeos da adenina através da membrana mitocondrial interna, através de uma nucleotídeo translocase. Admite-se que o atractilosídeo seja capaz de inibir especificamente esse translocador de ADP para dentro da mitocôndria e do ATP para fora desta organela, através de um transporte acoplado.
c) Desacopladores da fosforilação oxidativa:
Existe uma importante classe de reagentes que afetam a síntese de ATP, mas de uma maneira que não envolve ligação direta a nenhuma das proteínas da cadeia transportadora de elétrons ou mesmo à partícula FoF1-ATP sintase. Esses agentes são conhecidos como desacopladores, porque eles corrompem o fino acoplamento que existe entre o transporte de elétrons e a ATP sintase. Esses desacopladores agem pela dissipação do gradiente de prótons através da membrana mitocondrial interna, criado pelo sistema de transporte de elétrons. Exemplos típicos desse tipo de substância incluem o 2,4-dinitrofenol, dicumarol e o fluorocarbonil-cianeto fenilhidrazona ou FCCP.
Esses compostos apresentam duas importantes peculiaridades comuns: caráter hidrofóbico e próton dissociável. Como desacopladores, eles funcionam como carregadores de prótons através da membrana interna. Sua tendência é adquirir prótons na superfície citoplasmática da membrana, ou espaço intermembrana, onde a concentração de prótons é grande e carregam os prótons para o lado da matriz, portanto destruindo o gradiente de prótons que acopla o transporte de elétrons e a ATP sintase. Na mitocondria tratada com desacopladores, o transporte de elétrons continua, e os prótons são levados para fora da membrana interna. Contudo, eles retornam para dentro tão rapidamente via desacopladores que a síntese de ATP não ocorre. Consequentemente, a energia liberada no transporte de elétrons é dissipada como calor.
Ironicamente, certos animais adaptados ao frio, animais estes que hibernam e animais recém-nascidos, geram grande quantidade de calor pelo desacoplamento da fosforilação oxidativa. O tecido adiposo nesses organismos contém tanta mitocôndria que é chamado tecido adiposo marrom pela cor conferida pelas mitocôndrias. A membrana interna dessas mitocôndrias contém uma proteína endógena chamada termogenina, ou proteína desacopladora, que cria um canal passivo de prótons pelo qual os prótons fluem do citosol para matriz, gerando grande quantidade de calor.
Na figura abaixo pode-se observar a estrutura de alguns inibidores da respiração:
Figura 1. Estrutura de alguns inibidores da respiração. Fonte: Buchanan et al. (2000).
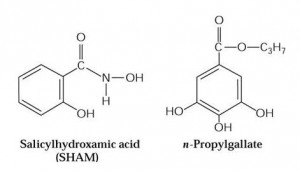
d) Inibidores da Oxidase alternativa
Figura 2. Ácido salicilhidroxâmico (SHAM) e o n-propilgalato.
Veja também: