A via glicolítica tem um papel duplo, que é a degradação da glicose para gerar ATP e o fornecimento de substratos para reações de síntese de algumas substâncias. A velocidade de conversão de glicose à piruvato é regulada para atender essas duas principais necessidade. A glicólise é provavelmente regulada cuidadosamente em todas as células, de modo que a energia é liberada a partir dos carboidratos somente na medida em que é necessária. Isto é confirmado pelo efeito do O2. Na glicólise, as reações catalisadas pela hexocinase, fosfofrutocinase e piruvato cinase são virtualmente irreversíveis: portanto espera-se que tenha papel regulador além de catalítico.
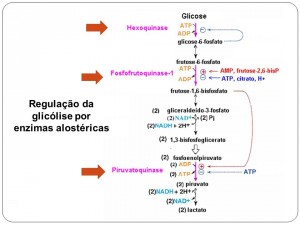
Figura 1. Regulação da glicólise. Fonte: http://slideplayer.com.br/slide/1603180/
HEXOQUINASE
O passo inicial na utilização de glicose na glicólise é a sua fosforilação por ATP para fornecer glicose-6-fosfato, esta reação é irreversível nas condições intracelulares e é catalisada pela hexoquinase. A reação de hexoquinase utiliza uma ligação do ATP de alto poder energético e forma um composto de baixo poder energético, que é a glicose-6-fosfato. Por apresentar uma inibição pelo produto, a hexoquinase para de funcionar logo que uma quantidade significativa de glicose-6-fosfato é produzida e permanece inativa até que o nível dessa molécula reduz como resultado de seu uso por outras reações.
Pode-se inferir que a hexoquinase é uma enzima reguladora, na qual a glicose-6-fosfato é tanto o substrato como o regulador alostérico.
FOSFOFRUTOCINASE
É um importante sítio de regulação metabólica porque a atividade desta enzima pode ser aumentada ou reduzida por um certo número de metabólitos comuns. Tais efeitos são do tipo alostérico, pois são resultados de uma interação entre o metabólito e o catalisador protéico em um sitio diferente daquele onde ocorre a catálise. A enzima requer Mg2+ e é específica para frutose-6-fosfato. Sua atividade é estimulada pelo ADP e quando há excesso de ATP ela é inibida. Além do ATP, o citrato e o isocitrato, podem agir como moduladores inibitórios da fosfofrutoquinase, atuando assim como efetores negativos. Por outro lado, o AMP, ADP e frutose-6-fosfato estimulam a enzima, fazendo papel de efetores positivos. Quando a relação ATP/ADP for alta a atividade da enzima fosfofrutoquinase é severamente inibida, no entanto quando esta mesma relação é baixa a fosfofrutoquinase tem sua atividade acelerada. Como em condições aeróbicas a relação ATP/ADP é alta, a velocidade da reação da fosfofrutoquinase é reduzida e consequentemente a glicólise também é reduzida. Dependendo do nível de Acetil CoA, o nível de intermediários do ciclo de Krebs pode aumentar.
Portanto, a inibição alostérica da fosfofrutoquinase, principalmente pelo ATP, é o principal mecanismo regulador da glicólise.
PIRUVATO CINASE
A reação da piruvatoquinase é um ponto de controle secundário na glicólise. É também uma enzima alostérica. Em altas concentrações de ATP, a afinidade aparente da cinase do piruvato pelo fosfoenolpiruvato é relativamente baixa e a velocidade da reação será igualmente baixa em concentrações normais de fosfoenolpiruvato. A cinase do piruvato é inibida também por Acetil CoA e por ácidos graxos de cadeia longa, ambos importantes combustíveis do Ciclo de Krebs. Assim, sempre que a célula já dispõe de uma concentração de ATP alta, a glicólise é inibida pela ação da fosfofrutoquinase ou da piruvato cinase. Por outro lado, em baixas concentrações de ATP, a afinidade aparente da piruvato cinase pelo fosfoenolpiruvato aumenta, este comportamento capacita a enzima a transferir o grupo fosfato do fosfoenolpiruvato para o ADP.
