Na glicólise, inicialmente, a glicose, um açúcar de 6 carbonos, é dividida em dois açúcares de 3 carbonos, que são oxidados e rearranjados para produzir duas moléculas de piruvato, que serão utilizalizadas no Ciclo de Krebs. Além disso, a glicólise produz uma pequena quantidade de energia química na forma de ATP e NADH. Este processo não requer oxigênio para converter glicose a piruvato, e o metabolismo glicolítico pode se tornar o principal modo de produção de energia em tecidos vegetais em baixos níveis de oxigênio, por exemplo, em raízes de solos alagados.
A glicólise consiste de 10 reações catalizadas por uma série de enzimas solúveis localizadas no citosol. De maneira geral nas reações iniciais da glicólise, a hexose que entra (glicose ou frutose) é fosforilada duas vezes e então quebrada, produzindo duas moléculas de açúcar com 3 carbonos (gliceraldeído-3-fosfato). Esta série de reações requer gasto de duas moléculas de ATP por glicose e inclui duas das três reações irreversíveis da rota glicolítica que são catalizadas por quínases de hexoses (incluindo quínase da glicose e quínase da frutose) e fosfofrutoquinase, sendo que as reações da fosfofrutoquinase é um dos pontos de controle da glicólise.
Uma vez formado o gliceraldeído-3-fosfato, a rota glicolítica pode começar a extrair energia útil. A enzima desidrogenase do gliceraldeído-3-fosfato catalisa a oxidação do aldeído a ácido carboxílico, liberando energia suficiente para permitir a redução de NAD+ em NADH e a fosforilação de gliceraldeído-3-fosfato para produzir 1,3-bifosfoglicerato, o qual é forte doador de grupos fosfatos.
No próximo passo, em um processo catalisado pela quínase do fosfoglicerato, o fosfato do carbono 1 do 1,3-bifosfoglicerato é transferido para uma molécula de ADP, produzindo ATP e 3-fosfoglicerato. Para cada glicose que entra, 2 ATPs são gerados por esta reação, sendo um para cada molécula de 1,3-bifosfoglicerato. Este tipo de síntese de ATP se refere a fosforilação a nível de substrato, envolvendo a transferência direta de um fosfato de uma molécula de substrato para ADP para formar ATP. Esta fosforilação é diferente do mecanismo de síntese de ATP durante a fosforilação oxidativa que é usada pela cadeia de transporte de elétrons, no estádio final da respiração.
O fosfato do 3-fosfoglicerato é transferido para o carbono 2 e uma molécula de água é removida, produzindo fosfoenolpiruvato (PEP). O grupo fosfato do PEP também tem alta energia livre de hidrólise e esta energia livre faz com que o PEP se torne um excelente doador de fosfato para formação de ATP. No passo final que é a terceira reação irreversível da glicólise, produz duas moléculas adicionais de ATP para cada hexose que entra na rota (Fig. 1).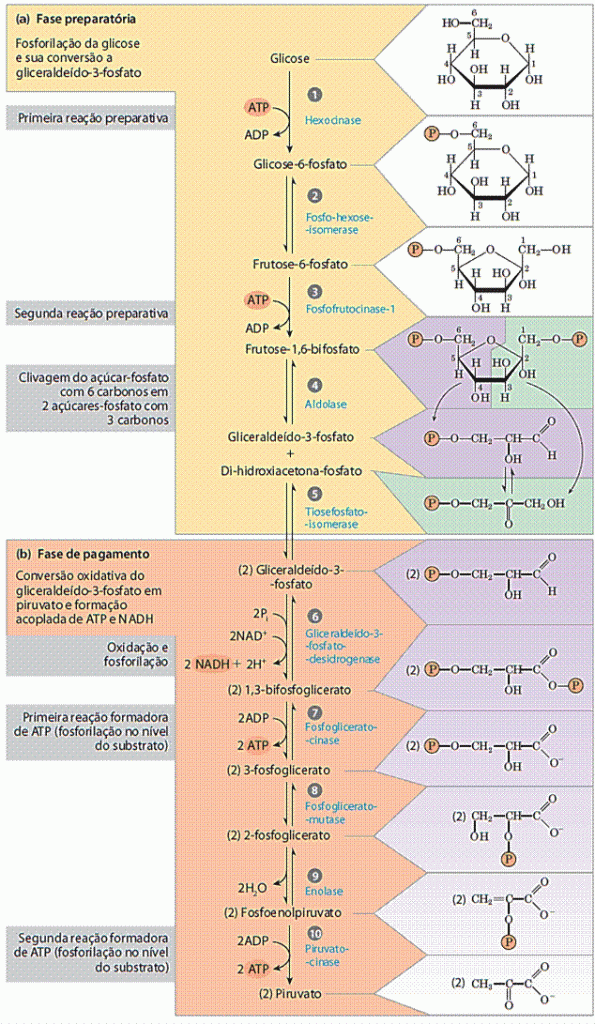
Figura 1: As duas fases da glicólise. Para cada molécula de glicose que passa pela fase preparatória (a), duas moléculas de gliceraldeído-3-fosfato são formadas; as duas passam pela fase de pagamento (b). O piruvato é o produto final da segunda fase da glicólise. Para cada molécula de glicose, dois ATP são consumidos na fase preparatória e quatro ATP são produzidos na fase de pagamento, dando um rendimento líquido de dois ATP por molécula de glicose convertida em piruvato. As reações numeradas correspondem aos títulos numerados discutidos no texto. Lembre-se que cada grupo fosforil, representado aqui como P , possui duas cargas negativas (-PO2-3). (LEHNINGER, 2014).
A fase preparatória da glicólise requer ATP
1. Fosforilação da glicose
No primeiro passo a glicose é ativada para as reações subsequentes pela sua fosforilação no C-6, formando glicose 6-fosfato, que será o doador de fosfato para o ATP. Esta reação é irreversível sob as condições intracelulares e é catalisada pela hexoquinase:
As quínases são um subclasse das transferases e catalisam a transferência do grupo fosforila terminal do ATP para um receptor nucleofílico qualquer. A hexoquinase além de catalisar a fosforilação da D-glicose, também catalisa de outras hexoses comuns, como a D-frutose e a D-manose.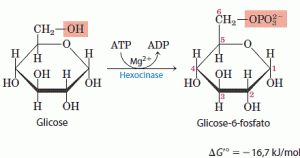 Para a hexoquinase ser ativada é necessário que tenha a presença de Mg2+, que mascara as cargas negativas do grupo fosforila do ATP e faz do átomo de fósforo terminal um alvo mais fácil para o ataque nucleofílico por um grupo -OH da glicose. A hexoquinase sofre ajuste induzido quando se liga a molécula de glicose, dessa forma, dois domínios da proteína aproximam-se quando o ATP se liga. Esse movimento leva o ATP ligado mais próximo da molécula de glicose também ligada na enzima e bloqueia o acesso de água (do solvente) que poderia entrar no sítio ativo e hidrolisar as ligações fosfoanidrido do ATP. Essa enzima é uma proteína citosólica e solúvel, que está presente em todas as células de todos os organismos.
Para a hexoquinase ser ativada é necessário que tenha a presença de Mg2+, que mascara as cargas negativas do grupo fosforila do ATP e faz do átomo de fósforo terminal um alvo mais fácil para o ataque nucleofílico por um grupo -OH da glicose. A hexoquinase sofre ajuste induzido quando se liga a molécula de glicose, dessa forma, dois domínios da proteína aproximam-se quando o ATP se liga. Esse movimento leva o ATP ligado mais próximo da molécula de glicose também ligada na enzima e bloqueia o acesso de água (do solvente) que poderia entrar no sítio ativo e hidrolisar as ligações fosfoanidrido do ATP. Essa enzima é uma proteína citosólica e solúvel, que está presente em todas as células de todos os organismos.
2. Conversão da glicose 6-fosfato em frutose 6-fosfato
A enzima isomerase da hexose fosfato catalisa a isomerização reversível de uma aldose, glicose 6-fosfato, em cetose, frutose 6-fosfato:
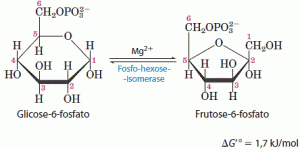 Como previsto pela variação relativamente pequena da energia livre-padrão, essa reação processa-se facilmente em qualquer das duas direções. Esta isomerização tem um papel crítico na química global da via glicolítica, uma vez que o rearranjo dos grupos carbonila e hidroxila nos C-1 e C-2 é uma condição necessária para os dois passos seguintes.
Como previsto pela variação relativamente pequena da energia livre-padrão, essa reação processa-se facilmente em qualquer das duas direções. Esta isomerização tem um papel crítico na química global da via glicolítica, uma vez que o rearranjo dos grupos carbonila e hidroxila nos C-1 e C-2 é uma condição necessária para os dois passos seguintes.
3. Fosforilação da frutose 6-fosfato em frutose 1,6 bifosfato
Na segunda das duas reações de ativação da glicolise, a fosfofrutoquinase-1 (PFK -1) catalisa a transferência de um grupo fosfato do ATP para a frutose 6-fosfato para liberar a frutose 1,6-bifosfato.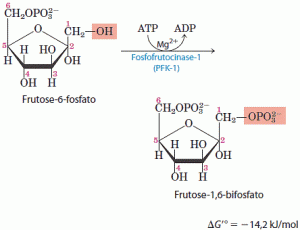 A reação da PFK-1 é essencialmente irreversível e é o primeiro passo “comprometido” da via glicolítica, pois a glicose-6-fosfato e a frutose- 6-fosfato podem ter outros destinos, mas a frutose-1,6-bifosfato é dirigida para a glicólise. A fosfofrutoquinase-l, como a hexoquinase, é uma enzima reguladora, sendo uma das mais complexas. Ela representa o ponto principal de regulação da glicólise.
A reação da PFK-1 é essencialmente irreversível e é o primeiro passo “comprometido” da via glicolítica, pois a glicose-6-fosfato e a frutose- 6-fosfato podem ter outros destinos, mas a frutose-1,6-bifosfato é dirigida para a glicólise. A fosfofrutoquinase-l, como a hexoquinase, é uma enzima reguladora, sendo uma das mais complexas. Ela representa o ponto principal de regulação da glicólise.
A atividade da PFK-1 é aumentada sempre que o suprimento de ATP da célula se torna baixo ou quando existe um excesso dos produtos da hidrólise do ATP, ADP e AMP. Essa enzima é inibida sempre que a célula tem amplo suprimento de ATP e quando ela está bem suprida de outros combustíveis como os ácidos graxos. Em alguns organismos, a frutose 2,6-bifosfato (que não deve ser confundida com a frutose 1,6- bifosfato que é o produto da ação da PFK-1) é um potente ativador alostérico da fosfofrutoquinase-1.
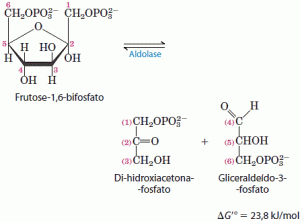
4. Clivagem da frutose 1,6-bifosfato
A enzima aldolase catalisa a condensação reversível de grupos aldol. A frutose 1,6-bifosfato é quebrada para liberar duas trioses fosfato diferentes, o gliceraldeído 3-fosfato, uma aldose, e a diidroxiacetona fosfato, uma cetose.
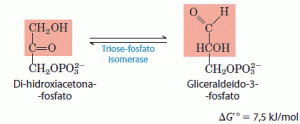
5. Interconversão das trioses fosfato
Apenas uma das trioses fosfato formada pela aldolase, o gliceraldeído 3-fosfato, pode ser diretamente degradada nos passos subsequentes da glicólise. Entretanto, o outro produto, a diidroxiacetona fosfato, é rápida e reversivelmente convertido em gliceraldeído 3-fosfato pela quinta enzima da sequência glicolítica, a isomerase da triose fosfato.
Depois da reação da isomerase da triose fosfato, os átomos do C-1, C-2 e C-3 da glicose inicial tornam-se indistinguíveis de C-6, C-5 e C-4, respectivamente, o que torna possível o metabolismo completo dos seis átomos de carbono da molécula da glicose.Esta reação completa a fase preparatória da glicólise.
A fase de pagamento da glicólise produz ATP e NADH
6. Oxidação do gliceraldeido 3-fosfato em 1,3-bifosfoglicerato
O primeiro passo da fase de pagamento da glicólise é a conversão do gliceraldeído 3-fosfato em 1,3-bi-fosfoglicerato, catalisado pela desidrogenase do gliceraldeído 3-fosfato.
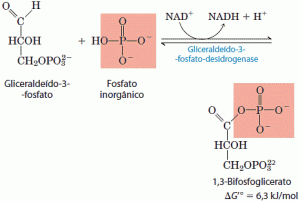 Essa é a primeira das duas reações conservadoras da energia da glicólise e que no final levam à formação do ATP. O grupo aldeído do gliceraldeído 3-fosfato é desidrogenado, não em um grupo carboxila livre, mas em um anidrido de ácido carboxílico com o ácido fosfórico. Esse tipo de anidrido, chamado um acilfosfato, tem energia livre-padrão de hidrólise muito alta (ΔG’ = -49,3kJ/mol). A maior parte da energia livre de oxidação do grupo aldeído do gliceraldeído 3-fosfato é conservada pela formação do grupo acilfosfato em C-1 do 1,3-bifosfoglicerato. O gliceraldeído 3-fosfato está ligado de maneira covalente à desidrogenase durante a reação catalisada pela desidrogenase do gliceraldeído 3-fosfato.
Essa é a primeira das duas reações conservadoras da energia da glicólise e que no final levam à formação do ATP. O grupo aldeído do gliceraldeído 3-fosfato é desidrogenado, não em um grupo carboxila livre, mas em um anidrido de ácido carboxílico com o ácido fosfórico. Esse tipo de anidrido, chamado um acilfosfato, tem energia livre-padrão de hidrólise muito alta (ΔG’ = -49,3kJ/mol). A maior parte da energia livre de oxidação do grupo aldeído do gliceraldeído 3-fosfato é conservada pela formação do grupo acilfosfato em C-1 do 1,3-bifosfoglicerato. O gliceraldeído 3-fosfato está ligado de maneira covalente à desidrogenase durante a reação catalisada pela desidrogenase do gliceraldeído 3-fosfato.
7. Transferência do fosfato do 1,3-bifosfoglicerato para ADP
A enzima fosfoglicerato quínase transfere o grupo fosfato de alta energia do grupo carboxila do 1,3-bifosfoglicerato para o ADP, formando ATP e 3-fosfoglicerato.
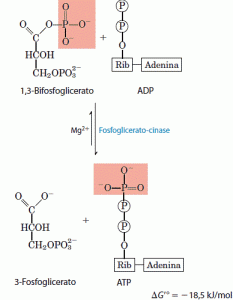 Juntos, os passos 6 e 7 da glicólise constituem um processo acoplador de transferência de energia no qual o intermediário comum é o 1,3-bifosfoglicerato, ele é formado na primeira reação (que é endergônica quando isolada), e na segunda reação (que é fortemente exergônica) seu grupo acilfosfato é transferido ao ADP para formar ATP. A soma das duas reações gera um energia ΔG’ = -l2,5kJ/mol, sendo a reação global exergônica. O passo 7 consome o produto do passo 6 (1,3-bifosfoglicerato) e, assim, no equilíbrio dinâmico mantém 1,3-bifosfoglicerato em níveis relativamente baixos.
Juntos, os passos 6 e 7 da glicólise constituem um processo acoplador de transferência de energia no qual o intermediário comum é o 1,3-bifosfoglicerato, ele é formado na primeira reação (que é endergônica quando isolada), e na segunda reação (que é fortemente exergônica) seu grupo acilfosfato é transferido ao ADP para formar ATP. A soma das duas reações gera um energia ΔG’ = -l2,5kJ/mol, sendo a reação global exergônica. O passo 7 consome o produto do passo 6 (1,3-bifosfoglicerato) e, assim, no equilíbrio dinâmico mantém 1,3-bifosfoglicerato em níveis relativamente baixos.
O resultado do acoplamento dessas duas reações, ambas reversíveis nas condições celulares, é que a energia liberada na oxidação de um aldeído a um grupo carboxilato, é conservada pela formação concomitante de ATP com o emprego de ADP e Pi, A formação de ATP pela transferência de um grupo fosfato de um substrato como o 1,3-bifosfoglicerato é referida como fosforilação ao nível do substrato, para distinguir seu mecanismo daquele da fosforilação ligada à respiração.
8. Conversão da 3-fosfoglicerato em 2-fosfoglicerato
A enzima mutase do fosfoglicerato catalisa a transferência reversível do grupo fosfato entre C-2 e C-3 do glicerato. O íon Mg2+ é essencial para essa reação.
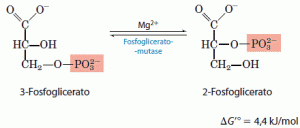 A reação ocorre em dois passos, um grupo fosforila, inicialmente ligado a um resíduo de histidina no sítio ativo da enzima, é transferido para o grupo hidroxila em C-2 do 3-fosfoglicerato, formando 2,3-bifosfoglicerato. O fosfato em C-3 do 2,3-bifosfoglicerato é então transferido para o mesmo resíduo de histidina da enzima, produzindo 2-fosfoglicerato e regenerando a enzima fosforilada. Como a enzima é inicialmente fosforilada pela transferência de fosfato do 2,3-bifosfoglicerato, esse composto funciona como um co-fator; ele é requerido em pequenas quantidades para iniciar o ciclo catalítico e continuamente regenerado por esse ciclo.
A reação ocorre em dois passos, um grupo fosforila, inicialmente ligado a um resíduo de histidina no sítio ativo da enzima, é transferido para o grupo hidroxila em C-2 do 3-fosfoglicerato, formando 2,3-bifosfoglicerato. O fosfato em C-3 do 2,3-bifosfoglicerato é então transferido para o mesmo resíduo de histidina da enzima, produzindo 2-fosfoglicerato e regenerando a enzima fosforilada. Como a enzima é inicialmente fosforilada pela transferência de fosfato do 2,3-bifosfoglicerato, esse composto funciona como um co-fator; ele é requerido em pequenas quantidades para iniciar o ciclo catalítico e continuamente regenerado por esse ciclo.
9. Desidratação do 2-fosfoglicerato em fosfoenol piruvato
A segunda reação glicolítica que gera um composto com alto potencial de transferência do grupo fosforila é catalisada pela enolase. Essa enzima promove a remoção reversível de uma molécula de água do 2-fosfoglicerato para liberar fosfoenolpiruvato (PEP).
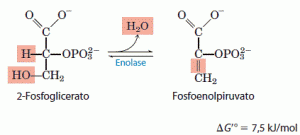 A respeito da variação relativamente pequena da energia livre-padrão nessa reação, há uma grande diferença da energia livre-padrão de hidrólise do grupo fosforila do reagente e do mesmo grupo do produto. Aquela do 2-fosfoglicerato (um éster de fosfato de baixa energia) é -17,6kJ/mol, e aquela do fosfoenol piruvato (um composto fosfato de energia superalta), -61,9kJ/mol. Embora o 2-fosfoglicerato e o fosfoenolpiruvato contenham, cada um, perto da mesma quantidade total de energia, a saída da molécula de água do 2-fosfoglicerato provoca a redistribuição da energia interna da molécula e aumenta muito a energia livre-padrão de hidrólise do grupo fosforila.
A respeito da variação relativamente pequena da energia livre-padrão nessa reação, há uma grande diferença da energia livre-padrão de hidrólise do grupo fosforila do reagente e do mesmo grupo do produto. Aquela do 2-fosfoglicerato (um éster de fosfato de baixa energia) é -17,6kJ/mol, e aquela do fosfoenol piruvato (um composto fosfato de energia superalta), -61,9kJ/mol. Embora o 2-fosfoglicerato e o fosfoenolpiruvato contenham, cada um, perto da mesma quantidade total de energia, a saída da molécula de água do 2-fosfoglicerato provoca a redistribuição da energia interna da molécula e aumenta muito a energia livre-padrão de hidrólise do grupo fosforila.
10. Transferência do grupo fosfato do fosfoenolpiruvato para ADP
O último passo na glicólise é a transferência do grupo fosfato do fosfoenolpiruvato para o ADP, catalisada pela quínase do piruvato, uma enzima que requer K+ e Mg2+ ou Mn2+.
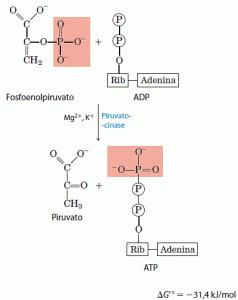 Nessa reação, de fosforilação ao nível do substrato, o produto piruvato aparece primeiro na sua forma enol que tautomeriza de maneira rápida, embora não-enzimática, para a forma ceto do piruvato. A reação total tem uma variação de energia livre-padrão grande e negativa, devido, em grande parte, à conversão espontânea da forma enol do piruvato em sua forma ceto. O ΔG’ de hidrólise do fosfoenolpiruvato é -61,9kJ/mol; cerca de metade dessa energia é conservada na formação da ligação fosfoanidrido do ATP (ΔG’ = -30,5kJI moI) e o restante (-31,4kJ/mol) constitui uma grande força que empurra a reação no sentido da síntese do ATP. A reação da quinase do piruvato é essencialmente irreversível sob condições intracelulares e um importante sítio de regulação.
Nessa reação, de fosforilação ao nível do substrato, o produto piruvato aparece primeiro na sua forma enol que tautomeriza de maneira rápida, embora não-enzimática, para a forma ceto do piruvato. A reação total tem uma variação de energia livre-padrão grande e negativa, devido, em grande parte, à conversão espontânea da forma enol do piruvato em sua forma ceto. O ΔG’ de hidrólise do fosfoenolpiruvato é -61,9kJ/mol; cerca de metade dessa energia é conservada na formação da ligação fosfoanidrido do ATP (ΔG’ = -30,5kJI moI) e o restante (-31,4kJ/mol) constitui uma grande força que empurra a reação no sentido da síntese do ATP. A reação da quinase do piruvato é essencialmente irreversível sob condições intracelulares e um importante sítio de regulação.
Veja também:
Referências Bibliográficas:
Buchanan, B. B.; Gruissem,w.; Jones, R. L. Biochemistry e Molecular Biology of Plants. 2. Ed. Chichester: Wiley-Blackwell, 2015. 1283p.
Giegé, P.; Heazlewood, J.L.; Roessner-Tunali,U.; Millar, A.H.; Fernie, A.R.; Leaver, C.J.; Sweetlove, L.J. Enzymes of Glycolysis Are Functionally Associated with the Mitochondrion in Arabidopsis Cells. The Plant Cell, v. 15, p. 2140-2151, 2003
Lehninger, A.L.; Nelson, D.L.; Cox, M.M. Princípios da Bioquímica de Lehninger. 6. Ed. Porto Alegre: Artmed, 2014. 425p.
Taiz, L.; Zeiger, E.; Moller, L. M.; Murfhy, A. Fisiologia e desenvolvimento vegetal. 6. ed., Artmed, 2017. 528 p.