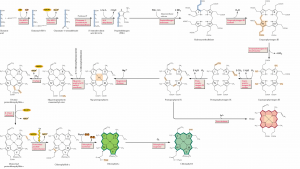
A rota de síntese das clorofilas pode ser dividida em várias fases, podendo cada uma ser considerada isoladamente, porém, na célula, são altamente coordenadas e reguladas. Essa regulação é essencial, pois a clorofila, quando livre, e muitos dos intermediários biossintéticos são prejudiciais aos componentes celulares. O dano pode ser grande, pois as clorofilas absorvem a luz eficientemente, porém, na ausência das outras proteínas do sistema de transporte, elas não possuem a rota para liberar a energia, resultando na formação de singletos de oxigênio.
Na primeira fase da biossíntese de clorofila, o aminoácido glutamina é convertido a ácido 5-aminolevulínico (ALA) (Figura 1). Esta reação é incomum, de modo que é necessário envolver um intermediário covalente, no qual o a glutamina é prendida, além de haver a transferência de uma molécula de RNA. Esta é uma das poucas reações bioquímicas na qual um tRNA é utilizado em um processo diferente de síntese de proteína. São condensadas duas moléculas de ALA então para formar ácido porfobilinogênico (PBG), o qual no final das contas forma os anéis pirrólicos da clorofila. A próxima fase é a assembléia de uma estrutura de porfirina de quatro moléculas de PBG. Esta fase consiste em seis passos enzimáticos distintos, terminando com a protoporfirina de produto IX. Nos animais, a partir daí, é inserido um átomo de ferro (Fe) no centro do anel pirrólico para formar o grupo heme, enquanto que no primeiro passo da rota da clorofila é inserido um átomo de magnésio (Mg), formando Mg-protoporfirina IX.
O quinto anel forma-se consequentemente pela ciclização da cadeia lateral de um dos ácidos propiônicos, formando o protoclorofilídeo. A conversão de Mg-protoporfirina IX em protoclorofilídeo envolve, em primeiro lugar, a esterificação do resíduo propiônico no carbono 6, realizada por uma metil transferase com S-adenosilmetionina como doador do grupo metil. O fechamento do anel começa a partir de Mg 2,4-divinilprotoporfirina IX metil éster (Mg- protoporfirina monometil éster), resultando em Mg 2,4-divinilfaeoporfirina a5 metil éster (divinil protoclorofilídeo a) ou, por outro caminho, formando Mg-vinil-faeoporfirina IX metil éster (monovinil protoclorofilídeo a – protoclorofilídeo). Este também pode ser formado pela redução do composto anterior. A produção do anel envolve a seguinte seqüência: acrilato ® b-hidroxipropionato ® b-cetopropionato, com o fechamento do anel no carbono g-metino. Esses passos têm evidência genética.
O protoclorofilídeo é reduzido a clorofilídeo na presença de luz, envolvendo a redução de uma ligação dupla no quarto anel, mediada pela enzima protoclorofilídeo oxidorredutase (POR), que usa um NADPH.
Nas angiospermas, a redução do protoclorofilídeo depende de luz, enquanto que gimnospermas, algas e bactérias fotossintéticas apresentam, além da protoclorofilídeo redutase dependente de luz, uma protoclorofilídeo redutase independente de luz.
O passo final na síntese de clorofila a envolve esterificação da cadeia lateral do fitol hidrofóbico, catalisada pela enzima clorofila sintetase.
Os cloroplastos das plantas superiores sempre contêm dois tipos de clorofila. Uma é invariavelmente a clorofila a e a segunda, em muitas espécies, é a clorofila b. As formas distintas de clorofila apresentam diferentes cadeias laterais no anel ou diferentes graus de saturação do anel. A clorofila b é sintetizada da clorofila a por meio da ação de uma enzima oxigenase que converte um grupo metil ligado ao anel II a aldeído. Isso altera as propriedades de absorção de luz das clorofilas. A absorção é também alterada pela interação de clorofila com proteínas encontradas na membrana fotossintética.
Durante o início do enverdecimento, a razão clorofila a/ b é alta, indicando uma produção mais rápida de clorofila a do que de clorofila b. Essa razão sofre alteração quando as plântulas são submetidas a estresse hídrico, sendo que a taxa de formação do complexo clorofila a/b-proteína é também reduzida.
Vários são os fatores externos e internos que afetam a biossíntese de clorofilas, alterando os seus conteúdos foliares de maneira significativa. Entre estes fatores, a luz é essencial a sua síntese. A clorofila está sendo constantemente sintetizada e destruída (foto-oxidação) em presença de luz, porém sob intensidades luminosas mais elevadas ocorre maior degradação, e o equilíbrio é estabelecido a uma concentração mais baixa. Folhas de sombra possuem concentração maior de clorofila do que as folhas de sol.
A rota de quebra das clorofilas em folhas senescentes é bastante diferente da rota de síntese. A primeira etapa é a remoção da cauda de fitol por uma enzima conhecida como clorofilase, seguida pela remoção do magnésio pela magnésio dequelatase. Em seguida, a estrutura de porfirina é aberta por uma enzima oxigenase (dependente de oxigênio), formando um tetrapirrol de cadeia aberta.
O tetrapirrol é modificado para formar produtos hidrossolúveis e incolores. Tais metabólitos incolores são exportados do cloroplasto senescente e transportados para o vacúolo, onde são permanentemente armazenados. Os metabólitos da clorofila não são mais processados ou reciclados, embora as proteínas associadas a eles no cloroplasto sejam recicladas subseqüentemente para novas proteínas. Acredita-se que a reciclagem das proteínas seja importante para a economia de nitrogênio pela planta.