1. Compostos Nitrogenados e Sulfatados
Diversos compostos do metabolismo secundário possuem N ou S em sua estrutura; devido essa conformação (acompanhado por N ou S), estes recebem o nome de compostos nitrogenados ou sulfatados. Neste grupo encontram-se os alcalóides, glicosídeos cianogênicos, aminoácidos não proteicos e glucosinolatos. Esses compostos, bem como os demais grupos de compostos do metabolismo secundário, possuem funções biológicas diversificadas; atuam especialmente na defesa das plantas contra a herbivoria e possuem efeitos tóxicos ao ser humano e propriedades medicinais.
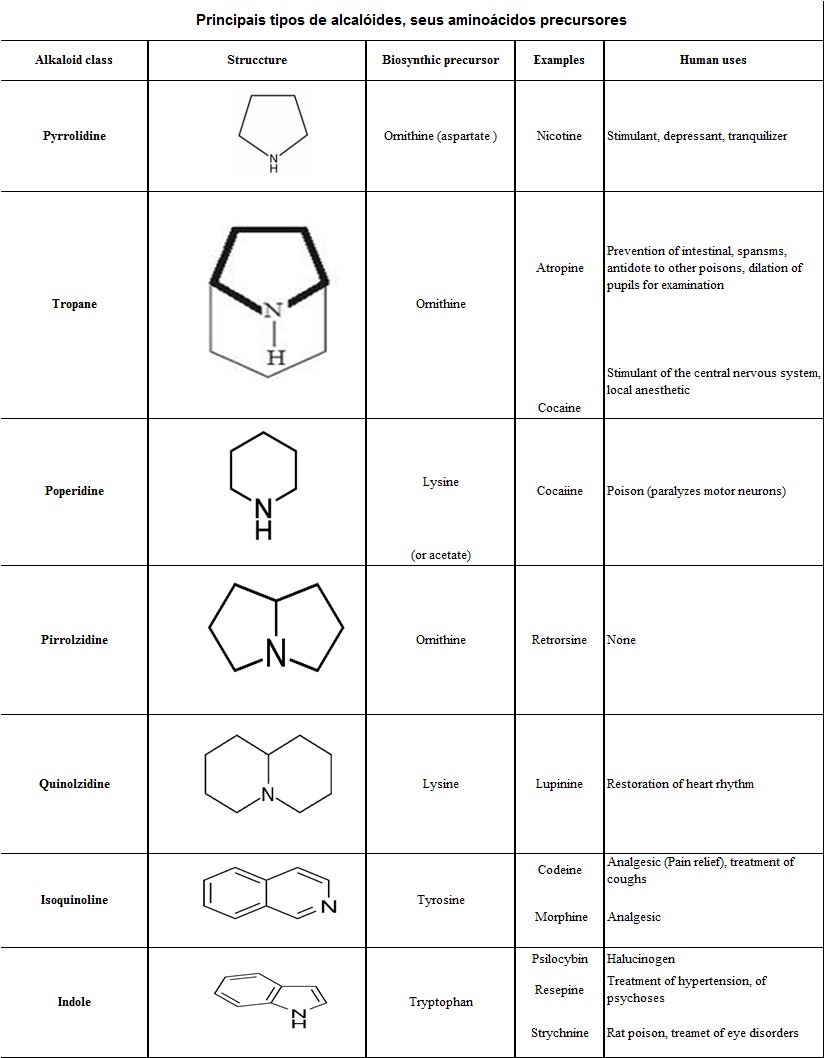
1.1 Alcalóides
Alcalóides são compostos de baixo peso molecular, encontrados em aproximadamente 20% das plantas vasculares. Geralmente, o átomo de N faz parte do anel heterocíclico (estrutura que possui átomos de N e C). Os alcalóides são conhecidos por exercerem efeitos farmacológicos benéficos em animais vertebrados (WANG et al., 2010; TAIZ & ZEIGER, 2009; ROZE et al., 2011). Alguns exemplos são: droga anticâncer, vimblastina; analgésicos, morfina e codeína; relaxante muscular, papaverina; bem como outros compostos como a cafeína, cocaína, nicotina e colchicina (ZIEGLER & FACCHINI, 2008; ROZE et al., 2015).
A biossíntese dos alcalóides baseia-se fortemente em substratos aminoácidos que incluem ornitina, lisina, prolina, tirosina e triptofano; contudo, o esqueleto de carbono de alguns alcalóides apresenta um componente derivado da rota dos terpenos. Os principais tipos de alcalóides são apresentados na tabela abaixo (Tabela 3) (ROZE et al., 2015): A maquinaria biossintética dos alcalóides vegetais apresenta algumas características em comum:
- Acumulam-se dentro de vários tipos de células e tecidos
- As enzimas da via estão localizadas em múltiplos compartimentos subcelulares
- Formam complexos multienzimáticos
Tabela 1. Principais tipos de alcalóides, seus aminoácidos precursores e exemplos conhecidos de cada tipo. Adaptado de Taiz & Zeiger, 2017
Assim, sugere-se que os produtos intermediários e finais e enzimas envolvidas na biossíntese dos alcalóides são translocados não apenas dentro de uma célula, mas também entre as células que pertencem a diferentes tipos de tecidos. Por exemplo, os alcalóides indólicos monoterpenóides (TIA) gerados em Catharanthus roseus se acumulam em células especializadas chamadas de idioblastos e laticíferos, no entanto, as enzimas envolvidas na via de biossíntese são encontradas nas raízes, órgãos fotossintéticos, na epiderme de folhas jovens e caules e em botões florais (ZIEGLER & FACCHINI, 2008; Wang et al., 2010).
Por muitos anos na história humana, os extratos vegetais têm sido utilizados como ingredientes em drogas e venenos. No leste do mediterrâneo, o uso do látex da papoula (Papaver somniferum) pode ser datado de pelo menos 1400 a 1200 A.C. Povos antigos usaram extratos de plantas medicinais como purgativos, antitussígenos, sedativos e para o tratamento de uma vasta gama de moléstias, incluindo picadas de cobras, febre e problemas mentais. O uso de plantas medicinais se espalhou em direção ao oeste pela Arábia e Europa, novas infusões e decocções desempenharam um papel em famosos eventos. Durante sua execução, em 399 A.C. o filósofo Sócrates bebeu um extrato de coniína da planta cicuta (Conium maculatum). No último século A.C. a rainha Cleópatra utilizou extratos de meimendro egípcio (Hyoscyamus niger), o qual contém atropina, para dilatar suas pupilas e parecer mais atraente para os seus rivais políticos.
Em adição ao principal impacto sobre a medicina moderna, os alcalóides têm influenciado a geopolítica mundial. Notórios exemplos incluem a guerra do Ópio entre a China e a Inglaterra (1839-1859) e os esforços atuais em vários países de erradicar a produção ilícita da heroína, um composto semissintético derivado por acetilação da morfina, e a cocaína, um alcaloide de ocorrência natural da planta da coca. Devido às suas várias atividades farmacológicas, os alcalóides têm influenciado a história humana profundamente, tanto para bem ou para o mal. De grande interesse para os biólogos, entretanto, é o processo de seleção evolucionária em plantas, que tem causado o desenvolvimento de alcalóides em um grande número de estruturas complexas que se mantêm efetivas durante milênios.
Muitas plantas são usadas hoje como drogas prescritas. Um dos alcalóides prescritos mais conhecidos é a antitussígena e analgésica codeína da papoula. Alcalóides vegetais têm também servido como modelos para drogas sintéticas modernas, tais como o alcaloide tropânico atropina usada como tropicamida, para dilatar a pupila durante exames oftalmológicos e o alcalóide derivado indólico antimalárico quinina para cloroquina.
Assim, sugere-se que os produtos intermediários e finais e enzimas envolvidas na biossíntese dos alcalóides são translocados não apenas dentro de uma célula, mas também entre as células que pertencem a diferentes tipos de tecidos. Por exemplo, os alcalóides indólicos monoterpenóides (TIA) gerados em Catharanthus roseus se acumulam em células especializadas chamadas de idioblastos e laticíferos, no entanto, as enzimas envolvidas na via de biossíntese são encontradas nas raízes, órgãos fotossintéticos, na epiderme de folhas jovens e caules e em botões florais (ZIEGLER & FACCHINI, 2008; WANG et al., 2010).
Por muitos anos na história humana, os extratos vegetais têm sido utilizados como ingredientes em drogas e venenos. No leste do mediterrâneo, o uso do látex da papoula (Papaver somniferum) pode ser datado de pelo menos 1400 a 1200 A.C. Povos antigos usaram extratos de plantas medicinais como purgativos, antitussígenos, sedativos e para o tratamento de uma vasta gama de moléstias, incluindo picadas de cobras, febre e problemas mentais. O uso de plantas medicinais se espalhou em direção ao oeste pela Arábia e Europa, novas infusões e decocções desempenharam um papel em famosos eventos. Durante sua execução, em 399 A.C. o filósofo Sócrates bebeu um extrato de coniína da planta cicuta (Conium maculatum). No último século A.C. a rainha Cleópatra utilizou extratos de meimendro egípcio (Hyoscyamus niger), o qual contém atropina, para dilatar suas pupilas e parecer mais atraente para os seus rivais políticos.
Em adição ao principal impacto sobre a medicina moderna, os alcalóides têm influenciado a geopolítica mundial. Notórios exemplos incluem a guerra do Ópio entre a China e a Inglaterra (1839-1859) e os esforços atuais em vários países de erradicar a produção ilícita da heroína, um composto semissintético derivado por acetilação da morfina, e a cocaína, um alcaloide de ocorrência natural da planta da coca. Devido às suas várias atividades farmacológicas, os alcalóides têm influenciado a história humana profundamente, tanto para bem quanto para o mal. De grande interesse para os biólogos, entretanto, é o processo de seleção evolucionária em plantas, que tem causado o desenvolvimento de alcalóides em um grande número de estruturas complexas que se mantêm efetivas durante milênios.
Muitas plantas são usadas hoje como drogas prescritas. Um dos alcalóides prescritos mais conhecidos é a antitussígena e analgésica codeína da papoula. Alcalóides vegetais têm também servido como modelos para drogas sintéticas modernas, tais como o alcaloide tropânico atropina usada como tropicamida, para dilatar a pupila durante exames oftalmológicos e o alcalóide derivado indólico antimalárico quinina para cloroquina.
1.2 Participações em processos de defesa química
Algumas plantas, tais como a vinca (Catharanthus roseus) contém mais de 100 alcalóides indólicos monoterpenoídicos diferentes. A função dos alcalóides em plantas tem sido uma questão pouco compreendida, mas recentemente sustenta-se um papel de defesa química para os alcalóides em plantas devido à sua grande abrangência de efeitos fisiológicos em animais e pelas atividades antibióticas que muitos alcalóides possuem. Vários alcalóides são também tóxicos a insetos, ou funcionam como detergentes. Por exemplo, a nicotina, encontrada no tabaco, foi um dos primeiros inseticidas usados pelo homem e continua sendo um dos mais efetivos. A herbivoria estimula a biossíntese de nicotina em plantas selvagens de tabaco. Outra toxina para insetos efetiva é a cafeína, encontrada nas sementes e folhas de cacau (Theobroma cacao), café (Coffea arabica), guaraná (Paullinia cupana), a cola (Cola nitida), o chá (Camellia sinensis) e o mate (Ilex paraguaiensis).
Dois grupos de alcalóides que têm sido muito estudados com relação à função ecoquímica são os pirrolizidínicos e quinolizidínicos. Os pirrolizidínicos são frequentemente encontrados em membros da tribo Senecionaceae (Asteraceae) e em Boraginaceae, tornando a maioria destas plantas tóxicas a mamíferos. Em espécies de Senecio, a senecionina N-óxido é sintetizada nas raízes e transportada pela planta. Nas plantas, os alcalóides pirrolizidínicos ocorrem naturalmente na forma de N-óxidos não-tóxicos, mas tornam-se altamente tóxicos quando reduzidos a alcalóides terciários hidrofóbicos não-carregados pelas citocromo P450 monoxigenases no fígado dos animais. Assim, são potencialmente letais, sendo responsáveis por envenenamento de animais domésticos e também representam um perigo à saúde humana. Por outro lado, várias espécies de insetos têm se adaptado a estes alcalóides, possuindo mecanismos desenvolvidos para uso destes alcalóides em benefício próprio. Alguns insetos podem se alimentar de plantas produtoras de alcalóides pirrolizidínicos e eliminar com eficácia os alcalóides após modificação enzimática. As mariposas da espécie Tyria jacobeae são capazes de reconverter o alcalóide terciário pirrolizidínico à forma N-óxido não tóxica, estocando-a no próprio corpo, defendendo-se dos predadores.
Os alcaloides quinolizidinicos ocorrem primariamente no gênero Lupinus e são frequentemente referidos como alcaloides do tremoço; são tóxicos a animais pastejadores particularmente aos ovinos. Devido ao seu sabor amargo, os alcaloides do tremoço podem também funcionar como detergentes. Em uma população mista de tremoço doce e amargo, os coelhos e lebres evitam se alimentar destes últimos, indicando que os alcaloides do Lupinus funcionam como redutores da herbivoria e como toxina. Com tais exemplos, os alcaloides podem ser vistos como uma parte do sistema de defesa química da planta desenvolvido sob processo de seleção ou predação.
1.3 Compostos constitutivos de defesa, alguns alcalóides são sintetizados em resposta a danos no tecido vegetal
Estudos mostram que larvas da lagarta do tabaco (Manduca sexta) alimentadas com folhas injuriadas atingem apenas metade do ganho de peso obtido por outras que se alimentam com folhas oriundas de plantas sem injúrias. A síntese indutível de nicotina e outros alcalóides parece envolver o metil-jasmonato, um regulador de crescimento de plantas volátil. O pool de jasmonato endógeno aumenta rapidamente quando as células da planta são tratadas com um elicitor preparado de paredes celulares de fungos. Mais de 140 espécies de plantas cultivadas respondem à adição de metil-jasmonato pelo aumento da produção de produtos naturais. Embora estudos deste tipo com plantas intactas não sejam tão extensivos quanto os com cultura de células em suspensão, exemplos claros têm sido demonstrados com plantas de tabaco, nas quais a injúria da folha produz um aumento no pool de ácido jasmônico endógeno de caules e raízes.
1.4 Biossínteses de Alcalóides
Até a metade do século XX, o conhecimento acerca da biossíntese de alcalóides em plantas estava baseado na hipótese biogênica. Na década de 50, contudo, a biossíntese de alcalóides tornou-se uma ciência experimental, com moléculas orgânicas marcadas radioativamente que se tornaram disponíveis para o teste de hipóteses. Estes experimentos estabeleceram que os alcalóides fossem, na maioria dos casos formados de L-aminoácidos (triptofano, tirosina, fenilalanina, lisina e arginina, por exemplo), tanto isolados ou em combinação com um esteróide, secoiridóide (por exemplo, secologanina), ou com uma porção terpenóide. Uma ou duas transformações podem converter estes aminoácidos universais, de metabólitos primários a substratos para o metabolismo de alcalóides altamente característico de cada espécie.
O alcalóide indólico monoterpenoídico (AIM) derivado do triptofano – ajmalicina – foi o primeiro alcalóide para o qual a biossíntese foi esclarecida no nível enzimático; nestes estudos, foram utilizadas culturas de suspensão de células vegetais da vinca de Madagascar (Catharanthus roseus).
Em plantas, a biossíntese de ajmalicina, e mais de 1800 outros AIM’s começa com a descarboxilação do L-triptofano pela triptofano descarboxilase para formar triptamina. Então, a triptamina, pela ação da strictosidina sintase é estereoespecificamente condensada com o secoiridóide secologanina (derivada do geraniol em múltiplos processos enzimáticos) para formar 3-a-strictosidina. A strictosidina pode então ser enzimaticamente permutada de um modo característico de cada espécie em diversas estruturas.
Alguns alcalóides não são derivados de aminoácidos e sim de uma base nitrogenada. Esse é o caso da cafeína (1,3,7 trimetilxantina), uma xantina produzida a partir de uma purina. Contudo, as purinas por sua vez derivam de aminoácidos tais como glicina, ácido L-aspártico e L-glutamina.
Três N-metiltransferases estão envolvidas na biossíntese de cafeína, entre elas estão a theobromina sintase e a cafeína sintase, as quais adicionam grupos metil à xantosina para convertê-la em cafeína. Além das metilações, um dos passos da biossíntese de cafeína envolve a remoção de um resíduo de ribose pela N-metilxantina nucleosidase.
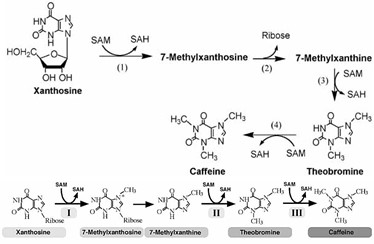 Figura 1. Rota central da biossíntese de cafeína. Enzimas: (1) 7-metilxantosina sintase (xantosina N-metiltransferase), (2) N-metilxantina nucleosidase, (3) theobromina sintase (7-metilxantina N-metiltransferase) e/ou cafeína sintase (7-metilxantina e theobromina). (Fonte: www.bioscience.org/ 2004/v9/af/1367/figures.htm).
Figura 1. Rota central da biossíntese de cafeína. Enzimas: (1) 7-metilxantosina sintase (xantosina N-metiltransferase), (2) N-metilxantina nucleosidase, (3) theobromina sintase (7-metilxantina N-metiltransferase) e/ou cafeína sintase (7-metilxantina e theobromina). (Fonte: www.bioscience.org/ 2004/v9/af/1367/figures.htm).
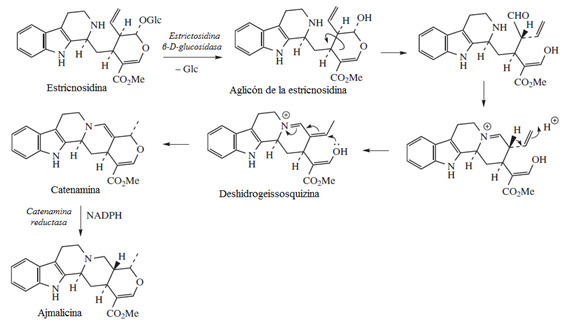 Figura 2. Biossíntese da ajmalicina e compostos relacionados em Catharanthus roseus. A Triptamina é derivada do L-triptofano por descarboxilação; a secologanina é derivada em múltiplos passos do monoterpeno geraniol (Fonte: Buchanan, 2000).
Figura 2. Biossíntese da ajmalicina e compostos relacionados em Catharanthus roseus. A Triptamina é derivada do L-triptofano por descarboxilação; a secologanina é derivada em múltiplos passos do monoterpeno geraniol (Fonte: Buchanan, 2000).
Figura 3. A estrictosidina, produto da condensação da triptamina e da secologanina é o precursor de muitos alcalóides específicos. (Fonte: Buchanan, 2000).
1.5 Aplicações biotecnológicos da pesquisa de biossíntese de alcaloides
O alcalóide deve primeiro passar por ensaios químicos; se estes forem sucedidos, eventualmente será necessário material suficiente para satisfazer a demanda de mercado. Pesquisadores podem desenvolver síntese biomimétrica, que duplica ao menos parte das rotas biossintéticas das plantas para produzir compostos sintéticos. Alternativamente, eles podem alterar o metabolismo da planta para mudar o perfil de alcalóides. A regulação da biossíntese de alcalóides em cultura de células pode também ser influenciada para a produção do alcalóide desejado.
A classe dos alcalóides tropânicos, encontrados principalmente em Solanaceae, contém as drogas anticolinérgicas hiosciamina e escopolamina. Certas espécies produtoras de alcalóides tropânicos acumulam hiosciamina em detrimento da escopolamina como alcalóide principal. A questão surge se a expressão de um transgene em uma planta medicinal alteraria o padrão de produção de alcalóide de modo que uma maior quantidade do alcalóide farmaceuticamente útil escopolamina fosse obtida. Com essa finalidade, uma hiosciamina cDNA codificadora 6-b-hidroxilase de Hyosciamus niger (meimendro) foi introduzido em Atropa belladona pelo uso de transformação mediada por Agrobacterium tumefaciens e A. rhizogenes. As plantas transgênicas resultantes e raízes cabeleira delas continham maiores concentrações de escoploamina do que as plantas tipo selvagem. Estas plantas transgênicas de Atropa forneceram o primeiro exemplo de como as plantas medicinais poderiam ser alteradas com sucesso pelo uso de técnicas de genética molecular para produzir elevadas quantidades de um alcalóide de importância medicinal.
Figura 4. A reação catalisada pela hiosciamina 6-β-hidroxilase ao longo da rota biossintética leva à formação do alcalóide escopolamina em espécies dos gêneros Hyosciamus, Duboisia e Datura. A enzima catalisa tanto a hidroxilação de hiosciamina quanto a sua epoxidação, formando a escopolamina. (Fonte: Buchanan 2000).
Outro exemplo de como a engenharia metabólica pode alterar a síntese de produtos naturais é a transformação de Brassica napus (canola) com o cDNA codificando a triptofano descarboxilase de Catharanthus roseus usada na biossíntese de alcalóides indólicos monoterpenoídicos. A utilização de sementes desta cultura produtora de óleo como alimento animal tem sido limitada em parte pela presença de glucosinolatos indólicos, compostos que contêm enxofre, compostos que tornam o alimento proteico menos palatável. O transgene da triptofano descarboxilase em canola redireciona o pool de triptofano para outra rota, que não a biossíntese de glucosinolatos indólicos e em triptamina (Figura 20). A semente madura de canola transgênica contém menos glucosinolatos indólicos e não acumula triptamina, tornando-a mais disponível para uso como alimento animal e obtendo um produto benéfico potencialmente econômico.
Figura 5. Engenharia metabólica para melhorar a qualidade do óleo de canola.
Uma cultivar de canola é transformada com um gene de Catharanthus roseus que codifica a triptofano descarboxilase, uma enzima envolvida na biossíntese de alcalóides indólicos monoterpenoídicos. O transgene direciona o pool de L-triptofano para a síntese de triptamina, em detrimento de glucosinolatos indólicos amargos. WT = tipo selvagem.
1.2 Glicosídeos Cianogênicos
Os glicosídeos cianogênicos são uma classe de compostos nitrogenados que também agem na defesa de plantas. Estes se caracterizam pela liberação do ácido cianídrico (HCN) quando hidrolisados enzimaticamente. São constituídos por um grupo nitrila, glucose (ou outro açúcar) e grupos R variáveis. A hidrólise do glicosídeo cianogênico (cianogênese) é catalisada por uma b-glucosidase formando derivativos hidroxinitrila (ou cianohidrina) instáveis, os quais, por ação da hidroxinitrila liase ou espontaneamente podem se converter em aldeídos e ou cetonas e em ácido cianídrico.
O catabolismo dos glicosídeos cianogênicos é iniciado pela clivagem da porção carboidrato por uma ou mais b-glicosidases, as quais produzem a correspondente a-hidroxinitrila. Investigações de b-glicosidases altamente purificadas de plantas que contêm dissacarídeos cianogênicos indicam que estes compostos podem ser degradados via duas rotas distintas, dependendo da espécie. A b-glicosidases de Davallia trichomanoides e Vicia angustifolia hidrolisa (R)-vicianina e (R)-amigdalina na ligação do dissacarídeo à aglicona produzindo mandelonitrila e o dissacarídeo correspondente. Alternativamente, a hidrólise de dissacarídeos cianogênicos de cerejeira (Prunus serotina), damasco (Prunus armeniaca) envolve a gradativa remoção dos resíduos de açúcares.
Sob condições regulares, a compartimentalização celular impede a decomposição do glicosídeo. Porém, quando a folha é lesada, durante a herbivoria, ocorre o contato entre enzimas e substratos, e o cianeto de hidrogênio (HCN) é liberado.
Os glicosídeos cianogênicos são amplamente distribuídos no reino vegetal e frequentemente são encontrados em leguminosas, gramíneas e membros da família Rosaceae. Em mandioca (Manihot esculenta), importante fonte de carboidratos, observa-se alto conteúdo de glicosídeos cianogênicos. Para o preparo de seus subprodutos, devem ser tomadas medidas adequadas para remoção ou degradação destes compostos, os quais podem causar envenenamento crônico.
Evidências indicam que os glicosídeos cianogênicos apresentam função protetora de certos vegetais. O HCN é uma toxina de ação rápida, que inibe as metaloproteínas, como a Fe-citocromooxidase, uma enzima chave no processo de respiração celular. A presença dos glicosídeos cianogênicos inibe a alimentação de insetos e outros herbívoros, tais como lesmas e caracóis. No entanto, assim como outros grupos de metabólitos secundários, alguns herbívoros são adaptados a se alimentar de plantas cianogênicas e toleram grandes doses de HCN.
Figura 6. (A) Hidrólise enzimática dos glicosídeos cianogênicos.
Para liberar ácido cianídrico. (B) R e R’ em (A) representam vários substituintes alquila ou arila. Por exemplo, se R é fenil, R’ é hidrogênio, e o açúcar é um dissacarídeo β-gentiobiose, o composto é amigdalina (um glicosídeo cianogênico comum encontrado nas sementes de amêndoa, damasco, cereja e pêssego). Outros compostos que liberam cianeto tóxico são durrina do sorgo, bem como linamarina e lotaustralina da mandioca. O grupo cianeto está marcado por um círculo (Taiz et al., 2017).
Os membros da família Poaceae, que inclui todas as culturas de cereais, usam benzoxazinoides (alcaloides derivados de triptofano) como metabólitos secundários de defesa, produzidos constitutivamente. Benzoxazinoides, especialmente 2,4-di-hidróxi-1,4-benzoxazin-3-ona (DIBOA) e seu derivado 2,4-di-hidróxi-7-metóxi-1,4-benzoxazin- 3-ona (DIMBOA), normalmente são armazenados no vacúolo como glicosídeos ligados à D-glicose. Após o dano, os glicosídeos inativos são hi-drolisados, gerando agliconas, que são tóxicas não só para insetos herbívoros, mas também para patógenos. Uma vez que a reação é reversível, DIBOA e DIMBOA podem ser desintoxicados pela formação de glicosídeos, uma reação catalisada por glicosiltransferases. Os benzoxazinoides liberados no solo pelas raízes de milho (Zea mays) e outros membros da família Poaceae também são tóxicos para as plantas vizinhas, mas podem ser desintoxicados por essas plantas por hidroxilação e reações de N-glicosilação.
Figura 7. Em membros da família Poaceae, os benzoxazinoides, alcaloides derivados da rota de triptofano, são os principais metabólitos secundários de defesa.
O composto 2,4-di-hidróxi-1,4-benzoxazin-3- -ona (DIBOA) e seu derivado 2,4-di-hidróxi-7-metóxi- 1,4-benzoxazin-3-ona (DIMBOA) são armazenados no vacúolo como glicosídeos (ligados à D-glicose, Glc). Após o dano, os glicosídeos são hidrolisados e liberam as agliconas tóxicas.
1.3 Glucosinolatos
Os glucosinolatos, um grupo de glicosídeos vegetais são também capazes de liberar substâncias de defesa quando decompostos. Foram identificados pelo menos 120 glucosinolatos, os quais estão presentes exclusivamente em dicotiledôneas, em maiores concentrações nos membros da família Brassicaceae (Cruciferae), sendo conhecidos com glicosídeos do óleo de mostarda
Os glucosinolatos são tioéteres, consistindo geralmente de um açúcar (b-D-tioglicose) com uma ligação éster a uma aglicona orgânica, a qual é um grupo alquil produzindo isotiocianato, nitrila, tiocianato ou um composto similar após hidrólise. Estes compostos frequentemente conferem um sabor amargo, com cheiro característico de condimentos (mostarda e raiz forte).
Os glucosinolatos são hidrolisados pela glicohidrolase ou tioglicosidase (mirosinase) a D-glicose, HSO4- e uma aglicona instável. Esta aglicona, dependendo do ambiente (pH intracelular, por exemplo) pode se rearranjar, para formar vários produtos: isotiocianatos, tiocianatos, nitrilas. Os glucosinolatos são produzidos no citoplasma e armazenados no vacúolo, até que as células sejam danificadas. As enzimas hidrolíticas são produzidas por plantas e por ruminantes, as quais reagem com os glucosinolatos quando o tecido vegetal é lesado.
Figura 8. Hidrólise de glicosinolatos em compostos voláteis da mostarda.
R representa vários substituintes alquila ou arila. Por exemplo, se R é CH2 = CH—CH2—, o composto é sinigrina, o principal glicosinolato das sementes de mostarda-preta e raízes de armorácia (raiz-forte) (Taiz et al., 2017).
Assim, os glucosinolatos, como os glicosídeos cianogênicos são compartimentalizados na planta intacta separadamente das enzimas que os hidrolisam, sendo degradados somente quando a planta é lesada. Os subprodutos da degradação da aglicona agem como repelentes a insetos e patógenos, induzindo o sistema de defesa da planta. Além disso, alguns estudos também têm mostrado efeito alelopático de glucosinolatos liberados no solo sobre canola (Brassica napus) e alfafa (Medicago sativa).
Assim como outros metabólitos secundários, alguns animais adaptaram-se à alimentação com plantas que contêm glucosinolatos, sem que haja efeitos danosos. Espécies de insetos são capazes de ingerir glucosinolatos e os manter em sua hemolinfa para se proteger contra predadores. Para os herbívoros adaptados, como, por exemplo, a borboleta do repolho, os glucosinolatos muitas vezes servem de estimulantes para a alimentação e oviposição, enquanto o isotiocianatos produzidos após a hidrólise dos glucosinolatos age como atrativos voláteis.
1.4 Aminoácidos não proteicos
Os aminoácidos não proteicos são um tipo especial de compostos que exercem sua atividade tóxica de diversas maneiras, bloqueando a síntese ou a absorção de aminoácidos não proteicos, ou mesmo substituindo-os na síntese de proteínas. Os aminoácidos não proteicos diferem dos demais por não se ligarem normalmente às proteínas, já que estão presentes na forma livre e atuam como substâncias protetoras. A canavanina, por exemplo, é um análogo da arginina, que pode ser incorporada às proteínas erroneamente, sendo reconhecida por uma enzima que normalmente liga a arginina à molécula de tRNA desse aminoácido, assim incorporando a canavanina, ao invés de arginina. O resultado desse processo é a produção de uma enzima não-funcional, pois a sua estrutura terciária ou seu sítio catalítico é desorganizado.
Os vegetais que sintetizam aminoácidos não proteicos não são susceptíveis à toxicidade desses compostos. As sementes de Canavalia ensiformis, que sintetizam grandes quantidades de aminoácidos não proteicos, apresentam uma maquinaria de síntese proteica, que pode distinguir entre a arginina e a canavanina, não incorporando esta última em suas proteínas. Alguns insetos que se especializaram em plantas que contém aminoácidos não proteicos apresentam adaptações bioquímicas semelhantes.
Figura 9. Molécula de Canavanina, um aminoácido não proteico análogo à arginina.
A canavanina pode ser incorporada a proteínas, tornando-a não-funcional. (Fonte: www.nutritionandmetabolism.com/…/ 1/7/figure/F1).