A fotorrespiração requer oito enzimas no núcleo fotorrespiratório para a reciclagem de 2PG produzido pela Rubisco e várias enzimas auxiliares. Em plantas superiores, as reações individuais são distribuídas ao longo do cloroplasto, o peroxissomo, a mitocôndria e o citosol (Figura 1), e fluxo de substrato requer muitos passos nas passagem pela membrana. Até agora, apenas dois transportadores do ciclo de nitrogenio na via fotorrespiratória foram identificados (WOO et al., 1987; REUMANN & WEBER, 2006), mas nenhum envolvidos no ciclo de carbono fotorrespiratório.
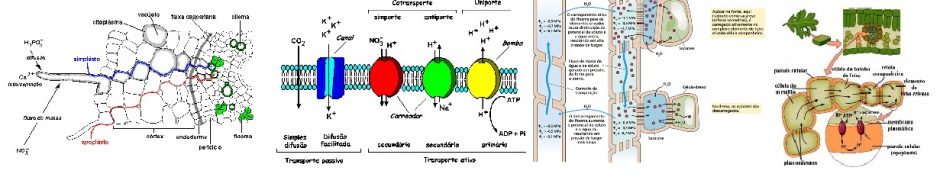
Figura 1. Seqüências metabólicas mostrando o envolvimento do cloroplasto, peroxissomo e mitocôndria, no ciclo C2 (ciclo oxidativo do carbono fotossintético – fotorrespiração). (TAIZ & ZEIGER, 2004).
(1) CLOROPLASTO
Índices absolutos de produção 2PG são determinados pela quantidade e propriedades cinéticas da Rubisco, bem como pela concentrações de O2, CO2 e RuBP. Dentro do cloroplasto, 2PG fosfatase altamente específicas (PGP) hidrolisa 2PG a glicolato (SCHWARTE & BAUWE, 2007). O glicolato se move para fora do cloroplasto através de um transportador antiporte glicolato-glicerato e entra no peroxissomo via canais de porina (REUMANN & WEBER, 2006).
(2) PEROXISSOMO
Glicolato oxidase (GOX) é uma enzima dependente de flavina mononucleotideo e está presente no peroxisomo e consome o O2 molecular e o glicolato para produzir H2O2 e glioxilato em uma reação irreversível. O H2O2 gerado é decomposto pela catalase (CAT). Em vez de GOX, as cianobactérias e algas usam o glicolato desidrogenase (GLD) para converter em glicolato e glioxilato usando NAD + como aceptor de elétrons, o que minimiza a geração de H2O2 nesses microorganismos. Há também indícios da presença simultânea de GOX e GLD em algas verdes (CHAUY, 2008). O próximo passo envolve duas reações paralelas, serina: – aminotransferase glioxilato (SGT) e glutamato: glioxilato aminotransferase (GGT), transaminação do glioxilato a glicina. SGT prefere serina como o doador amino (LIEPMAN & OLSEN, 2011). GGT usa glutamato produzido no ciclo fotorrespiratório do nitrogênio como o doador do grupo amino, mas também pode utilizar a alanina. Duas isoformas existem em Arabidopsis, onde GGT1 representa a principal forma de GGT em folhas (LIEPMAN; IGARASHI, 2003). Existe a hipótese de que glioxilato escapa das reações de transaminação sob condições de estresse sendo eliminado.
(3) MITOCÔNDRIA
Na mitocôndria, ocorre rendimento de duas moléculas de glicina uma molécula de serina pela ação combinada de glicina descarboxilase (GDC) e serina hidroximetiltransferase (SHMT). As duas enzimas estão presentes em alta concentração na matriz mitocondrial de folhas (DOUCE, 2001). A GDC é um sistema multienzimático composto por três enzimas (P, T e L-proteína) que, sucessivamente, reagem com uma proteína substrato comum (H-proteína). O ciclo de reação total requer uma molécula de glicina, tetrahidrofolato (THF) e NAD + para produzir uma molécula de metileno THF (CH2-THF). Além disso, uma molécula CO2 por NH3 liberada (por P e T-proteína, respectivamente) e NADH é produzido (por L-proteína). CO2 é possivelmente exportado como bicarbonato via complexo I-associados γ-anidrase carbônica (BRAUN et al., 2007; PETERS, 2008). Grande parte do NADH gerado é reciclado para NAD + dentro da mitocôndria, em um processo que é amplamente desacoplado da síntese de ATP, e uma menor fração é exportada para o citosol através do vaivém de malato (SCHEIBE, 2005). A SHMT combina com CH2-THF com uma segunda molécula de glicina para fazer serina e regenerar THF para GDC (VOLL et al., 2006). O papel de um segundo SHMT mitocondrial não é conhecido, mas semelhante ao SHMTs citosólica e plastidial poderia servir para gerar CH2-THF de serina para vias biossintéticas afins (HANSON et al., 2001).
(4) PEROXISSOMO
A serina retorna ao peroxisomo onde o grupo amino é transferido para glioxilato por BET e o hidroxipiruvato é produzido e reduzido a glicerato por NADH-dependente redutase hidropiruvato (HPR1). O NADH não é permeavel a membrana peroxisomal e deve ser gerado pela malato desidrogenase peroxissomal (pMDH), consumindo malato fornecidos a partir do cloroplastos e as mitocôndrias. Em contraste com o efeito deletério das interrupções no C2 outras reações do ciclo, nem a supressão de HPR1 nem o fortaleciamento de pMDH prejudica o crescimento da planta, isto é o hidroxipiruvato pode passar para o citosol onde é reduzido pela hidroxipiruvato redutase dependente-NADPH (HPR2). Enquanto fluxo através HPR2 é tipicamente baixo, este desvio citosólico permite um redirecionamento do fluxo fotorrespiratório de carbono quando a geração de NADH peroxisomal está limitando (TIM et al., 2008; COUSINS et al., 2008).
Finalmente, a enzima plastidial glicerato 3-quinase (GLYK) completa o ciclo C2 pelo 3PGA retornando e carrega três dos quatro átomos de carbono 2PG de volta para o ciclo de Calvin no cloroplasto. GLYK é a única enzima conhecida produtora de 3PGA. (BARTSCH et al., 2008; BOLDT et al., 2005).
A fotorrespiração co-evoluiu com a fotossintese oxigênica em cianobactérias. Durante os últimos cinco anos, as sequências de nucleotídeos de cerca de 50 genomas de cianobactérias se tornaram disponíveis, permitindo a análise global do metabolismo em 2PG nestes organismos (EISENHUT, 2008). Análises de sílica indicaram a presença de dois caminhos possíveis, um semelhante ao metabolismo respiratório de plantas e um similar para a via do glicerato bacteriano, em que glioxilato é convertido para glicerato via tartronic semialdeído (Figura 3).
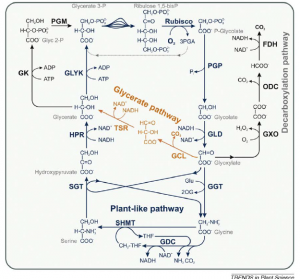
Figura 3. Metabolismo de cianobactérias, 2PG compreende sobreposição de vias em planta(azul) e bacterias (laranja e preto). Fonte: Bauwe et al., 2010.
Após estes estudos iniciais realizados com silicatos a presença de duas vias parcialmente sobrepostas do metabolismo fotorespiratoio foi proposto em mutantes com mutações triplas e duplas (EISENHUT et al., 2008). Esses experimentos também revelaram uma rota metabólica para a oxidação completa de glioxilato via oxalato e formiato de CO2, mas proteínas similares não são codificadas no genoma de outras cianobactérias (EISENHUT, 2008). Cianobactérias existentes dependem de mecanismos acumuladores de CO2 (CCM) para assimilar carbono inorgânico na atuais concentrações elevadas de O2. A combinação de alta afinidade e absorção de CO2 na forma de bicarbonato com um seqüestro da Rubisco em carboxissomos favorece fortemente a carboxilação da RuBP e inibe a oxigenação nesses microcompartimentos (PRICE et al., 2008). Portanto, muito tempo se pensou que o metabolismo fotorrespiratório não ocorria em cianobactérias (COLMAN, 1989). Entretanto, hipóteses atuais apontam para uma evolução de CCMs apenas cerca de 360-300000000 anos atrás, durante uma intermitente queda nos níveis atmosféricos de CO2 e um aumento nos níveis de O2 de> 30% no Período Carbonífero (PRICE et al., 2008).
Comparações detalhadas de genomas de cianobactérias apontam para a presença de um ciclo C2, com enzimas do caminho do glicerato bacteriano em todas as cianobactérias, sugerindo que a rotas metabólicas respectivamente evoluiram ou já existia na início da história de cianobactérias. Plantas aparentemente perderam as enzimas do caminho do glicerato. Em contraste, muitas enzimas do ciclo C2 tem sido conservada entre as cianobactérias e plantas (EISENHUT et al., 2008). A ocorrência de não apenas uma, mas duas 2PG sugerem duas rotas redundantes na maioria das cianobactérias, o ciclo C2 semelhantes a plantas e o caminho glicerato, sugere que pode 2PG não é apenas um metabolico tóxico, mas um recurso (BARTSCH et al., 2008). Além disso, as 2PG-fosfatases de cianobactérias não estão relacionadas com a enzima da planta correspondente e glicolato é oxidado a glioxilato por GLD na maioria das cianobactérias.Tudo isso sugere que o metabolismo 2PG é essencial para o viabilidade de todos os organismos que realizam fotossíntese aeróbica, independentemente de serem procariontes, eucariontes algas ou plantas.
Em plantas C3, metabolismo fotorrespiratório serve para (i) reciclar a grande quantidade de 2PG gerado na fase de luz da fotossintese para 3PGA e (ii) evitar o envenenamento por metabólitos nocivos, tais como 2PG-se (ANDERSON, 1971), glioxilato (KLECZKOWSKI, 1994) ou glicina (EISENHUT, 2007). Plantas C4 requerem um metabolismo 2PG para a sobrevivência, mas, devido ao mecanismo mais eficiente para fornecer CO2 a Rubisco pelo o ciclo fotossintético C4, produzem muito menos 2PG do que plantas C3. Isso lembra a situação metabólica em cianobacterias sobreviventes, que também concentram CO2 nas proximidades da Rubisco, e alguns dados sugerem que a desintoxicação do 2PG e compostos derivados poderia ser mais importante do que a reciclagem do 2PG nestes procariontes (EISENHUT et ., 2007).
O PROCESSO FOTORESPIRATÓRIO
Pode-se dizer ainda, que a fotorrespiração reflete a origem evolucionária da Rubisco, sobretudo nos tempos modernos, devido as baixas razões entre CO2 e O2 no ar atmosférico que conduzem a fotorrespiração, sem nenhuma outra função, senão a recuperação parcial do carbono presente no 2-fosfoglicolato. Existem evidências recentes em plantas transgênicas que a fotorrespiração em plantas C3 protege os cloroplastos da fotoxidação e da fotoinibição.
Uma das diferenças básicas entre fotorrespiração e respiração refere-se ao efeito do O2 sobre os dois processos. A respiração satura-se quando o O2 atinge aproximadamente 2%, enquanto que a fotorrespiração não alcança a saturação numa atmosfera pura de O2.
O fenômeno se interpreta como uma inibição da fotossíntese pelo O2. Esta inibição, denominada “Efeito Warburg” pode ser removida pelo aumento de CO2, sugerindo a existência de um processo competitivo com a fotossíntese.
O O2 pode causar três tipos de inibição fotossintética:
1) através da inibição direta da atividade da enzima rubisco, oxidando essa enzima e diminuindo a sua capacidade de fixação do CO2.
2) pela oxidação de clorofilas, lipídios membranares e compostos intermediários dos fotossistemas, na fotoinibição.
3) inibição ocorre pela função oxigenase da enzima rubisco, onde o substrato RuBP reage com o O2 ao invés de reagir com o CO2 (HALL & RAO, 1994). Essa função oxigenase, como a carboxilação, só ocorre em presença da luz e tem, por isto, o nome de fotorrespiração; possui, como primeiro produto, um composto com 3C, o ácido fosfoglicérico (PGA), que vai para o ciclo de Benson-Calvin, e um composto com 2C, o ácido fosfoglicólico (P-GLIC).
A princípio, o ácido fosfoglicólico não tem função no metabolismo celular. As duas funções da rubisco agem competitivamente, e a taxa fotorrespiratória varia de 15 a 45% da fotossíntese bruta (ZELITCH, 1971; LAWLOR, 1993). A taxa de liberação de CO2 fotorrespiratório, que é de 3 a 8 vezes a taxa de respiração, é aumentada pela luz, temperatura e teores de O2 (RITCHER, 1993). Portanto, em condições de alta luminosidade e altas temperaturas, a fotorrespiração de plantas C3 é aumentada, e a taxa fotossintética e a produção de biomassa, diminuídas (MARSCHNER, 1995).
O ácido fosfoglicólico, produzido na fotorrespiração, é desfosforilado a ácido glicólico (GLIC) e exportado do cloroplasto para o peroxissoma, onde é oxidado a ácido glioxílico (GLX). A reação da glicolato oxidase, formando o ácido glioxílico, produz também H2O2, que é reduzido pela ação da catalase.
Em seguida, o ácido glioxílico é aminado gerando a glicina (GLIA). A formação da glicina é acoplada ao sistema glutamato sintase/glutamina sintetase (GS/GOGAT) do cloroplasto, e o ácido glutâmico formado é exportado para o peroxissoma, onde ocorre a transaminação, cedendo o grupamento amino (-NH2) para a formação de uma glicina. O segundo grupamento amino para a segunda glicina, é oriundo da desaminação da serina (SER) a hidroxi-piruvato (OH-PIR) no próprio peroxissoma (BRYCE & THORNTON, 1996).
A glicina formada é transportada para a mitocondria, onde duas glicinas (2C cada) são transformadas em uma serina (3C), liberando o CO2 fotorrespiratório e o primeiro grupamento amino para a formação de uma glicina. A serina formada volta ao peroxissoma, onde é desaminada a ácido hidroxipirúvico, liberando o segundo grupamento amino para a formação da segunda glicina, havendo então um equilíbrio no fluxo de N (ZELITCH, 1973). Nessa organela, o ácido hidroxipirúvico é reduzido a ácido glicérico (GLIR) e este migra para o cloroplasto, onde é fosforilado a ácido fosfoglicérico (PGA) para entrar no ciclo de Benson-Calvin, consumindo pelo menos um ATP (OGREN, 1984).
Portanto, de cada quatro carbonos (duas glicinas) que entram na fotorrespiração, três carbonos são recuperados na forma do ácido fosfoglicérico e um é perdido na forma de CO2 (HALL & RAO, 1994). Nessa via, além do consumo de ATP para a formação do ácido fosfoglicérico, há consumo de um NADPH na redução do ácido hidroxipirúvico a ácido glicérico (LORIMER & BADGER, 1981) no peroxissoma. Porém, OGREN (1984) afirma que este NADPH consumido é produzido na mitocôndria, durante a descarboxilação de uma glicina e liberação do CO2 fotorrespiratório.