O fato de que a fotossíntese em plantas superiores é dirigida por dois sistemas fotoquímicos com diferentes propriedades de absorção de luz coloca um problema especial.
O fotossistema I absorve preferencialmente luz na faixa do vermelho-distante com comprimentos de onda acima de 680nm; o fotossistema II absorve preferencialmente luz na faixa do vermelho com comprimento de onda de até 680nm e é muito fracamente estimulado pelo vermelho-distante. Tal dependência de comprimentos de onda explica o efeito de melhora e o efeito de queda no vermelho. Outras diferenças entre os fotossistemas sâo:
– O fotossistema I produz um redutor forte, capaz de reduzir o NADP+, e um oxidante fraco;
– O fotossistema II produz um oxidante muito forte, capaz de oxidar a água, e um redutor mais fraco do que aquele produzido pelo fotossistema I.
O redutor produzido pelo fotossistema II re-reduz o oxidante produzido pelo fotossistema I.
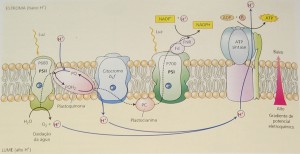
O esquema Z da fotossíntese é a base para a compreensão dos organismos fotossintéticos produtores de oxigênio. Ele é responsável pela operação dos fotossistemas física e quimicamente distintos (I e II), cada um com seus próprios pigmentos antena e centros de reação fotoquímicos. Os dois fotossistemas estão ligados por uma cadeia transportadora de elétrons que se posicionam em série (Figura 1).
Figura 1. Cadeia transportadora de elétrons na membrana dos tilacóides (TAIZ; ZEIGER, 2004).
Verifica-se que são necessárias duas reações luminosas para levar os elétrons do nível da água (+ 0,82 V) ao nível do NADP+ (-0.34 V); um em cada fotossistema. O PSI apresenta um máximo de absorção a 700 nm, enquanto no PSII, este pico ocorre a 680 nm, daí o fato de serem denominados de P700 e P680, respectivamente.
Quando os quanta de luz incidem no PSII, os pigmentos antenas (moléculas de clorofilas) absorvem energia fazendo com elas atinjam um estado máximo de excitação. Esta energia migra rapidamente para o centro de reação, que também ao ser excitado, libera um elétron que é transferido à feofitina, quando então, flui descendentemente pela cadeia de transporte (CTE) até o PSI, onde há novamente absorção e ativação do PSI, seguindo o transporte de elétrons até a ferredoxina, que ao ser reduzida, doa elétrons para, finalmente, reduzir o NADP+ a NADPH. Neste caso, os elétrons doados pelo PSII são então repostos pelos elétrons resultantes da oxidação da água.
Para que ocorra a transferência de energia via transporte de elétrons é necessário que cada transportador se torne alternadamente reduzido e oxidado. Redução significa receber elétrons, enquanto oxidação implica em doar elétrons para um determinado composto. Nestas condições, a substância doadora de elétrons torna-se oxidada e, o composto aceptor de elétrons, se reduz. Torna-se caracterizada, portanto, uma reação de óxido-redução, na qual tomam parte um redutor (doador de elétrons) e, um oxidante (receptor de elétrons). Concomitantemente, à migração de um elétron, ocorre a migração de um próton (H+). No final da CTE, o NADP+ é reduzido a NADPH. Ao longo da CTE, a energia dissipada é utilizada nas reações de fosforilação acíclica e cíclica do ADP, entre a plastoquinona/citocromo b, e no PSI, levando à produção de ATP
Se a taxa de divisão de energia para os fotossistemas I e II não é sincronizada precisamente e as condições são tais que a taxa de fotossíntese está limitada pela luz disponível (baixa intensidade luminosa), a taxa de fluxo de elétron será limitada pelo fotossistema que está recebendo menos energia. A situação mais eficiente seria aquela na qual a recepção de energia é a mesma em ambos os fotossistemas. Porém, nenhum arranjo único de pigmentos satisfaria esta exigência, porque em diferentes períodos do dia, a intensidade luminosa e a distribuição espectral tende a favorecer mais um ou o outro fotossistema. A solução para este problema seria um mecanismo de troca de energia de um fotossistema com o outro em resposta às diferentes condições, e tal qual um mecanismo regulador opere em condições experimentais diferentes. A observação de que o rendimento global de quantum da fotossíntese é quase independente do comprimento de onda dá fortes indicações que tal mecanismo existe. Progresso considerável tem sido conseguido no entendimento do mecanismo molecular que é responsável por esta redistribuição de energia. A membrana do tilacóide contém a proteína quinase que pode fosforilar um resíduo de treonina específico na superfície de uma ligação membrana-antena-pigmento protéico. Este complexo de pigmento-proteína é o LHCII. Quando LHCII não é fosforilado, ele entrega mais energia ao fotossistema II, e quando é fosforilado entrega mais energia ao fotossistema I. A quinase é ativada quando a plastoquinona, um dos carregadores de elétrons entre os fotossistemas, acumula-se no estado reduzido, o que acontece quando o fotossistema II está sendo ativado mais freqüentemente que fotossistema I. O LHCII fosforilado migra então para fora das regiões empilhadas da membrana em direção às regiões não empilhadas, provavelmente por causa de interações repulsivas entre cargas negativas de membranas adjacentes. A migração lateral de LHCII troca o equilíbrio de energia para o fotossistema I que fica situado na lamela do estroma e longe do fotossistema II que fica situado nas membranas empilhadas da grana. Esta situação é chamada estado 2. Se a plastoquinona se torna mais oxidado por causa do excesso de excitação do fotossistema I, a quinase é desativada e o nível de fosforilação de LHCII é diminuído pela ação de uma ligação de fosfatase da membrana. O LHCII move-se então de volta para a grana, e o sistema está no estado 1. O balanço resultante é um controle muito preciso da distribuição de energia entre os fotossistemas, permitindo o uso mais eficiente da energia disponível.
Alguns compostos como por exemplo herbicidas são capazes de interromper essa cadeia de transporte de elétrons, bloqueando a ocorrência dessa etapa fotossintética.