A fosforilação é a forma de energia usada pelas células para realizar os processos biológicos, os elétrons ricos em energia capturados na glicólise (NADH) e no ciclo de Krebs (na forma de NADH e FADH2) devem ser convertidos para ATP. Este processo dependente de O2 ocorre na parte interna da membrana interna da mitocôndria e envolve uma série de carreadores de elétrons, conhecida como cadeia de transporte de elétrons (CTE).
A respiração mitocondrial de plantas envolve a participação de duas principais rotas de transporte de elétrons.
1ª- Rota da oxidase do citocromo c: sensível ao cianeto e acoplada a três sítios de conservação de energia.
2ª- Rota alternativa insensível ao cianeto: envolve a oxidase alternativa (AOX), ramifica-se da rota da oxidase do citocromo, no “pool” de ubiquinonas, não havendo conservação de energia após esse ponto , uma vez que a AOX é capaz de oxidar diretamente o ubiquinol e reduzir o oxigênio a água.
Através da glicólise e do ciclo de Krebs, para cada molécula de glicose são geradas 2 moléculas de NADH no citosol, enquanto na matriz mitocondrial são geradas 8 moléculas de NADH e 2 moléculas de FADH2 (associada com a desidrogenase do succinato) aparecem na matriz mitocondrial. A cadeia transportadora de elétrons catalisa o fluxo de elétrons do NADH (e FADH2) para o O2, o aceptor final de elétrons no processo respiratório. A transferência de 2 elétrons do NADH é representado a seguir:
NADH + H+ + 1/2 O2 → NAD+ + H2O
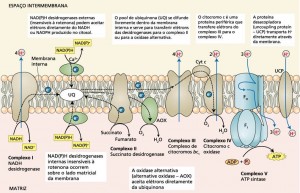
A cadeia transportadora de elétrons contém aproximadamente os mesmos sítios de carreadores de elétrons encontrado em mitocôndrias não vegetais. As proteínas individuais que transportam elétrons são organizadas em uma série de quatro complexos multiproteícos (complexo I a IV), cada um localizado no interior da membrana mitocondrial (Fig.1)
Complexo I = desidrogenase do NADH (oxidoredutase do NADH-ubiquinona)
Complexo II = desidrogenase do succinato (oxidoredutase do succinato-ubiquinona)
Complexo III = Citocromo b-c1 (oxidoredutase da ubiquinona-citocromo c)
Complexo IV = Oxidase terminal ( oxidoredutase do citocromo c-O2)
Elétrons do NADH gerados na matriz mitocondrial durante o ciclo Krebs são oxidados pelo complexo I (desidrogenase do NADH), que transfere estes elétrons para a ubiquinona. A enzima desidrogenase do succinato é um componente do complexo II, então os elétrons derivados da oxidação do succinato são transferidas via FADH2 e um grupo de três proteínas ferro-enxofre para o pool da ubiquinona. O complexo III age como um ubiquinol: a oxidoredutase do citocromo c, oxidando a ubiquinona reduzida (ubiquinol) e transferindo elétrons via centro ferro-enxofre.
Figura 1. Esquema geral da cadeia de transporte de elétrons
Complexo I:
É o maior dos 4 complexos, formado por 26 cadeias polipeptídicas, incluindo 7 centros de ferro/enxofre e a flavoproteína ligada ao FMN. Seu sítio de ligação com o NADH está voltado para a matriz mitocondrial, favorecendo a transferência de elétrons. A ubiquinona reduzida pelo complexo I difunde pela bicamada lipídica da membrana mitocondrial interna até o complexo III, este processo é mediador da transferência dos elétrons dos complexos I e II ao complexo III. Os prótons que acompanham os elétrons são lançados da matriz para o espaço intermembranas e deste, para o citosol da célula.
Complexo II:
Formado principalmente pela desidrogenase do succinato, a única enzima do ciclo de Krebs que está embebida na membrana mitocondrial interna. Possui 4 subunidades, incluindo 2 proteínas com grupos ferro/enxofre, e uma delas ligada ao FAD, a exemplo do complexo I, seus sítios de oxirredução do succinato também estão voltados para a matriz mitocondrial.
Complexo III:
Formado por 2 tipos de citocromo b (bL e bH), pelo citocromo c1, uma proteína ferro/enxofre e entre 4 a 6 proteínas adicionais. O caminho dos elétrons através do complexo III é sinuoso e complexo: o citocromo c que os recebe está localizado no lado do espaço intermembranas da mitocôndria. O citocromo c, por ser hidrossolúvel, tem baixa afinidade com a bicamada lipídica da membrana mitocondrial interna e se difunde através desta, mediando a conexão entre os complexos III e IV. O processo leva ao transporte de elétrons até o citocromo c, e ao bombeamento de prótons da matriz mitocondrial para o espaço intermembranas.
Complexo IV:
Contém cerca de 13 subunidades polipeptídicas e 2 átomos de cobre, além dos grupos heme característicos dos citocromos a e a3. Os elétrons doados pelo citocromo c são transportados através dos átomos de cobre e ferro até o lado da matriz mitocondrial, onde vão reduzir o O2 em H2O. A redução incompleta do O2 pode levar à geração de espécies químicas como o íon superóxido, o peróxido de hidrogênio e o radical hidroxil, todos muito reativos e tóxicos à célula.
Em adição a estes quatro complexos, as mitocôndrias de plantas possuem alguns componentes não comumente encontrados em mitocôndrias animais
I) Desidrogenase do NAD(P)H Externo – Proteínas periféricas encontradas na face externa da membrana interna. Estes componentes podem facilitar a oxidação de NADH e NADPH produzidos no citosol.
II) Desidrogenase do NAD(P)H Resistente à Rotenona– Proteínas periféricas encontradas na face interna da membrana interna. Estes componentes, ao contrário do complexo I, são resistentes à rotenona.
III) Oxidase Alternativa (AOX) – Este complexo protéico permite a redução de O2 com pequena produção de ATP. Esta oxidase alternativa, ao contrário do complexo IV, é pouco afetada pelos inibidores, cianeto, monóxido de carbono (CO) e azida.
A fosforilação oxidativa é o processo metabólico de síntese de ATP a partir da energia liberada pelo transporte de elétrons na cadeia respiratória. Todo o processo depende de dois fatores:
- a energia livre obtida do transporte de elétrons e armazenada na forma de gradiente de íons hidrogênio
- uma enzima transportadora denominada ATPsintase. Durante o fluxo de elétrons há liberação de energia livre em 3 locais da C.T.E.: Complexos I, III e IV. A energia liberada nesses complexos é suficiente para a síntese de ATP. Estes locais são denominados SÍTIOS DE FOSFORILAÇÃO OXIDATIVA.
Os quatro pares de hidrogênios (e seus elétrons) liberados no Ciclo de Krebs são imediatamente transportado para a Cadeia Respiratória que é um processo gerador de ATPs onde o O2 serve de aceptor final dos hidrogênios (e elétrons) gerando uma molécula de H2O por cada par de elétrons que são transportados pelo NADH e FADH2, gerados não só do Ciclo de Krebs, mas de qualquer outra reação metabólica celular.
A síntese de ATP resultante do transporte de elétrons, ocorre em virtude da energia livre liberada durante o fluxo de prótons que ocorre entre os complexos transportadores de elétrons e prótons que comunicam a matriz mitocondrial e o espaço intermembrana. Quando o NAD+ se reduz, formando NADH, nas reações de desidrogenação nas quais participa como co-fator enzimático dentro da matriz mitocondrial, há a passagem imediata dos elétrons, que retirou do substrato, para o complexo protéico denominado Complexo da desidrogenase do NADH ou Complexo I.
Este complexo possui um NAD+ e sete sítios contendo ferro e enxofre que funcionam como receptores de elétrons, reduzindo-se e oxidando-se quando há o fluxo eletrônico. O receptor final de elétrons, deste complexo, é a ubiquinona que converte-se em ubiquinol quando recebe os elétrons (se reduz).
Quando os elétrons atravessam o complexo I e são transferidos até a ubiquinona, há a um fluxo de um próton que atravessa a matriz em direção ao espaço intermembrana. Com esta passagem do próton, os elétrons são transportados para o complexo III, denominado, também de Complexo dos Citocromos bc1 ou Ubiquinona–citocromo c oxidorredutase.
A ubiquinona desloca-se do complexo I em direção ao complexo III, correspondendo a um transportador móvel. Este complexo contém os citocromos b562, b566, c1 e c, ligados a uma proteína ferro-enxofre e cerca de outras seis proteínas. Todo este complexo III está fixado na crista mitocondrial e é transmembrana, conectando a matriz e o espaço intermembrana (com exceção do citocromo c que conecta-se apenas com o espaço intermembrana).
O receptor final de elétrons deste complexo é o citocromo c que se reduz e transfere os elétrons para o complexo IV, denominado de oxidase do Citocromo. Nesta trasnferência, gera-se um fluxo de um próton da matriz para o espaço transmembrana (o segundo fluxo protônico). O citocromo c, do complexo III, é um transportador móvel que leva os elétrons para o complexo IV.
O complexo IV contém os citocromos a e a3 que possuem um grupamento heme (com um átomo de ferro) e estão ligados a uma proteína transmembrana que conecta a matriz com o espaço intermembrana e possui dois átomos de cobre que possibilita o transporte de elétrons para o aceptor final, o oxigênio (O2).
Quando os elétrons atravessam este complexo IV, gera-se um terceiro fluxo de um próton da matriz para o espaço intermembrana, com os elétrons sendo transferidos para o oxigênio, que se reduz formando água. Os dois prótons necessários para formar a água são retirados da matriz mitocondrial, ficando a água na mitocôndia podendo atravessar para o citoplasma.
Observe que um único par de elétrons transportado seqüencialmente pelos complexos I, III e IV, geram o fluxo de três prótons para o espaço intermembrana, com a formação de uma molécula de água.
O complexo II ou Complexo Succinato-ubiquinona, é uma única enzima fixa na crista mitocondrial mas que não comunica a matriz com o espaço intermembrana. Esta enzima é a desidrogenase do succinato que participa da 6ª reação do Ciclo de Krebs. Este complexo é formado por um FAD+ ligado a centros Ferro-enxofre. Ela transfere os elétrons provenientes do FADH2 para a o complexo III, mas de maneira diferente como os elétrons do NADH são transportados para o complexo III. Em virtude de não ser uma proteína transmembrana, não gera o fluxo de prótons que o complexo I gera, fornecendo um sítio de fluxo de prótons a menos que os elétrons transportados pelo NADH.
O fluxo de prótons gerado pela passagem dos elétrons pelos complexos I, III e IV (conhecidos, por isso, como bomba de prótons), fornece energia suficiente para a síntese de três ATPs, o que corresponde a uma relação de uma molécula de ATP para cada próton bombeado ou 3 moléculas de ATP para cada par de elétrons que passe pelos três complexos.
A energia necessária para a síntese de uma molécula de ATP, in vivo, corresponde a 12,51 kcal, muito maior que a energia livre padrão de 7,3 kcal necessárias para a síntese de ATP a partir de ADP e Pi. Isto se dá porque as concentrações dos substratos na célula são diferentes do valor de 1M que são utilizados no cálculo, além do que a temperatura intracelular é diferente de 25 ºC, o pH nem sempre é 7,0 nem a pressão é 1 ATM constantemente (condições padrões de temperatura, pressão e pH). Desta forma a energia liberada é suficiente para a síntese de até quatro ATPs (53,14 ¸ 12,51 = 4,25) por par de elétrons transportados pelo NADH. Da mesma forma, a redução do O2, a partir do par de elétrons transportados pelo FADH2, libera energia livre na ordem de 36,71 kcal. O que corresponde a energia suficiente para a síntese de quase três ATPs (36,7¸12,51 = 2,93). Como visto pela estequeometria das reações exergônicas acima descritas, energia livre não é problema para a síntese de ATP na mitocôndria. Entretanto, em estudos experimentais observou-se que há uma proporção de 3 moles de ATPs formados por cada mol de NADH oxidado (e mol de O2 reduzido em H2O, por conseguinte), da mesma forma que 2 moles de ATPs são formados para cada mol de FADH2 oxidado.
A teoria quimiosmótica que justifica esta proporção, postulada por Peter Mitchell, ainda na década de 60, admite que os prótons bombeados para o espaço intermembrana, durante o fluxo de elétrons na cadeia respiratória, criam um gradiente de baixo pH (devido à alta concentração de H+) e carga elétrica positiva no espaço intermembrana. A partir dessas diferenças de gradientes há movimentação de uma outra bomba de prótons, agora no sentido do espaço intermembrana para a matriz mitocondrial, através de um complexo protéico denominado complexo V que corresponde à enzima ATP sintase.
Esta enzima é semelhante a uma maçaneta tanto na forma quanto no movimento rotatório que realiza quando há o fluxo de próton do espaço intermembrana para a matriz mitocondrial. A porção correspondente à cabeça da maçaneta está voltada para a matriz mitocondrial e corresponde à subunidade F1 que contém os sítios de ligação do ADP e Pi para a formação do ATP.
Quando os prótons são jogados para o lado de fora da matriz mitocondrial, há a formação de um potencial eletroquímico positivo externo que favorece a passagem dos prótons de volta para a matriz por dentro do complexo V. Nesta passagem há a liberação de calor suficiente para a união do Pi com o ADP para formar o ATP.
Assim sendo, como cada par de elétron transportado pelo NADH produz um fluxo de 3 prótons para fora da mitocôndria, a entrada desses próton pelo complexo IV favorece a síntese de 3 ATPs, bem como os elétrons transportados pelo FADH2 produzem apenas 2 fluxos de prótons para fora da mitocôndria e, portanto, somente 2 ATPs são produzidos. Desta forma, a cadeia respiratória corresponde a um passo fundamental e decisivo no processo de formação de energia química armazenada no ATP, uma vez que há uma grande produção de NADH e FADH2 nos processos exergônicos da célula.
Um fato importante, entretanto, é que essa relação de 3 ATPs produzidos por cada NADH só é 100% verdadeira quando se trata de NADH produzido dentro da mitocôndria e que trasnfere seus elétrons para o complexo I. Alguns NADH produzidos no citoplasma não entram na mitocôndria e tem que “entregar” seus elétrons para uma lançadeira na membrana interna para poder entrar na cadeia respitarória. Quando a lançadeira é a desidrogenase do glicerol-3-P, uma proteína superficial da membrana interna em contato somente com o espaço intermembrana, há a transferência dos elétrons direto par complexo III, via ubiquinona, de forma semelhante aos elétrons transportados pelo FADH2. Desta maneira, quando há o transporte de elétrons do NADH citoplasmático via esta lançadeira, cada NADH produz somente 2 ATPs. Porém, a maioria das vezes, o NADH citoplasmático transfere seus elétrons diretamente para o complexo I através da via malato-aspartato e, neste caso a produção energética é idêntica ao NADH mitocondrial.
Vídeo sobre cadeia respiratória: clique aqui!
Veja também:
- Regulação e Inibição da C.T.E.
- Via respiratória alternativa
- Espécies Reativas de Oxigênio
- Bioenergética
Referências bibliográficas:
Taiz, L.; Zeiger, E. Fisiologia vegetal. 5. ed., Artmed, 2012. 918 p.
Artigo: