O Ciclo de Krebs ou Ciclo do Ácido Cítrico é uma via importante, pois, apresenta as funções de:
- oxidar acetil CoA à CO2 e H2O;
- fornecer elétrons para a cadeia de transporte de elétrons, gerando energia (ATP)
- sintetizar alguns intermediários que são precursores de compostos bioquimicamente importantes, que são sintetizados por outras rotas metabólicas.
Este ciclo ele é controlado de modo dinâmico pelo nível celular de nucleotídeos de adenina (ADP e ATP). A medida que a demanda celular por ATP no citosol diminui em relação à taxa de síntese de ATP nas mitocôndrias, menos ADP estará disponível, o que irá reduzir a atividade da Cadeia de Transporte de Elétrons. A redução na atividade da Cadeia de Transporte de Elétrons acarretará em uma acúmulo de NADH, inibindo várias desidrogenases do Ciclo do Ácido Cítrico.
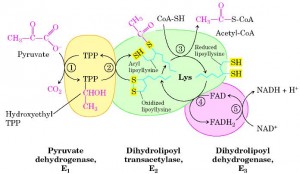
Complexo Desidrogenase do Piruvato
O complexo é formado por 3 enzimas e 5 coenzimas (Figura 1), sendo responsável pela formação de Acetil Coenzima A a partir de piruvato.
Figura 1: Complexo desidrogenase do piruvato. Fonte: www.lookfordiagnosis.com
As enzimas do complexo têm resíduos de serina, modificáveis por fosforilação, que quando fosforiladas (por quinases) são inativadas e quando desfosforiladas (por fosfatases) são ativadas.
Os produtos da via (NADH e acetil-CoA), bem como ATP são efetores alostéricos negativos das enzimas do complexo, pois eles ativam a quinase e inibem o complexo, já NAD+ atua como efetor positivo, pois sua alta concentração irá ativar as fosfatases ativando a enzima.
Modelos de regulação da oxidação alternativa
Dois modelos são apresentados por Buchanan et al. (2000):
- rota da respiração citocrômica (modelo A)
- respiração alternativa (modelo B)
O primeiro modelo (A) postula que a rota da respiração alternativa é tomada somente quando a respiração citocrômica está saturada. A decisão é tomada de acordo com a razão Qr/Qt, representando a taxa de ubiquinona reduzida, não disponível para o transporte de elétrons em relação à quantidade total de ubiquinonas. Quando a razão Qr/Qt é alta, poucas ubiquinonas estão livres para transportar elétrons, então a rota da respiração alternativa ocorreria. Nessa situação há um excesso de elétrons, devido ao excesso de poder redutor que pode ser resultante de bloqueio nas etapas finais da cadeia transportadora de elétrons ou excesso de substrato.
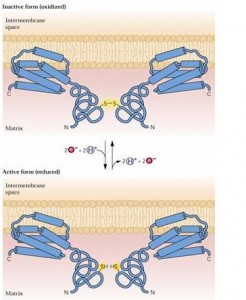
O segundo modelo (B) postula que a oxidação alternativa ocorre a baixa razão Qr/Qt, ou seja, há muitas ubiquinonas oxidadas (Figura 2). A oxidase alternativa (AOX) permanece inativa quando a ponte de dissulfeto é formada, mas no caso de excesso de poder redutor essa ligação é quebrada tornando-se ativa. A presença de cetoácidos (piruvato e glioxilato) na mitocôndria aumentam a atividade da AOX. O acúmulo de citrato induz a síntese de AOX, enquanto o NADPH gerado a partir da atividade da desidrogenase do citrato ativa a enzima. Este modelo assume a existência de outro mecanismo ainda não descoberto.
Figura 2. Modelos de regulação da oxidase alternativa. Fonte: Buchanan et al. (2000).
Atualmente acredita-se que o segundo modelo é o correto. Adicionalmente, acredita-se que a respiração citocrômica é bloqueada em situação de excesso de prótons no espaço inter-membranas em relação à matriz.
INIBIDORES DA RESPIRAÇÃO
A mitocôndria tem sido adequadamente chamada de “casa de força” da célula, por ser dentro desta organela que ocorre a maior parte da captura de energia formada a partir da oxidação de compostos orgânicos. Toda energia útil liberada durante a oxidação dos ácidos graxos e dos aminoácidos, e quase toda energia liberada a partir da oxidação dos carboidratos torna-se disponível dentro das mitocôndrias como equivalentes redutores. A mitocôndria contém uma série de catalisadores, conhecidos como cadeia respiratória, que coletam e transportam esses equivalentes redutores. O sistema mitocondrial que acopla esses equivalentes redutores a geração de um intermediário de alta energia – o ATP, é denominado de fosforilação oxidativa. A fosforilação oxidativa capacita os organismos, em comparação com os anaeróbicos, a capturar uma proporção muito maior de energia disponível dos substratos respiratórios. A teoria quimiosmótica oferece uma compreensão de como o processo é realizado. Certas drogas como o amobarbital e venenos como o cianeto e monóxido de carbono inibem a fosforilação oxidativa, geralmente com conseqüências fatais.